АВТОКОЛЕБАНИЯ В ФЕРМЕНТАТИВНЫХ РЕАКЦИЯХ
Нелинейности в кинетике биохимических, ферментативных, процессов проявляются в ряде случаев в наблюдаемой их периодичности. Происхождение колебаний в биохимических системах в целом понятно — они определяются автокаталитической системой реакций и в этом общем смысле моделируются периодическими реакциями в неживой природе. Таковы процессы, изученные Жаботинским и описанные в § 8.5, периодические окислительные реакции, теория которых развита Франк-Каменецким [65], и т. д. Общие обзоры, посвященные биохимическим колебаниям, содержатся в сборнике [66] (см. также статью Селькова [67] и монографию Жаботинского [19]).
Особенно четко периодичность биохимических процессов проявляется в реакциях гликолиза (анаэробного превращения ше - стичленных Сахаров в трикарбоновые кислоты), сопровождающегося синтезом АТФ [68, 69]. Упрощенная схема процесса показана на рис. 8.29 [68]. В опытах Чанса, Гесса и сотрудников были обнаружены сначала затухающие концентрационные колебания в гликолизе [70—72], затем были найдены условия возникновения незатухающих автоколебаний [73—75]. На рис. 8.30 показаны колебания концентрации одного из продуктов реакции гликолиза — НАД-Н [73], примечательные своим почти синусоидальным характером.
Реакция гликолиза реализуется в сложной полиферментной системе. Возможности возникновения автоколебаний в таких системах были исследованы Сельковым ([67, 76 -82], см. также [19]).
Проведем рассмотрение этой проблемы, следуя работе [79]. Химические процессы, подчиняющиеся закону действия масс, как правило, нелинейны. Нелинейны взаимодействия элементов полиферментной системы и взаимодействия таких систем друг с другом. В результате возникают регуляторные системы, так как их устойчивость непосредственно связана с нелинейностью. Сельков выделяет ключевые этапы в полиферментной системе, характеризуемые наиболее сильной нелинейностью и ответственные за регуляцию процеса. Эта основная нелинейность проявляется в гистерезисной зависимости квазистационарной скорости
Ключевой реакции от концентрации субстрата. Основная нелинейность возникает в результате совокупности механизмов, действующих независимо друг от друга.
Примером типичного био - J
Химического нелинейного процесса служат ферментативные реакции, ингибируемые избытком субстрата или кофермен - та, например, реакции с участием биосинтетических дегид - рогеназ, ингибируемые НАДФ - Н+. Такую реакцию можно представить схемой, показанной на рис. 8.31. Реакция
АТФ
К
-АДФ Сз Глюнозо-В-фосфат
L-—АТФ | АДФ
С3 Фрутш-1,0-&1ф№фт
Дио/гси - ацетт - фасфат
Л3
Ч
<?С3 Глщеролг>0ееа(?-3-фосфат
X + Y' —» X' + Y,
Катализируемая ферментом Е, ингибируется активной формой кофермента Y'. Скорость v конверсии Х->Х' в стационарных условиях можно выразить приближенной формулой
= УХУ'
° К, [к2 + У {1 + (Y'IKi)y}] '
(8.89)
Где V — величина, имеющая размерность скорости, пропорциональная концентрации фермента. Скорость поступления субстрата vu скорость регенерации кофермента из неактивной формы v2 и скорость использования кофермента Уз представим формулами
(8.90)
V\ = vm — k, X,
Щ = k2Y,
= W;
Щ, Фн НАД-Н
<?С5 1,3-
4с'ЛДФ
I f—ТФ
Л3 3-
2Zi г-
£Сз фасфажллируеат — /АДФ
-^/АТФ
НАД
/Cj Дарует — НАД-Н
НАД-Н ч ■ НАДО/
Дахтат Ртатл (мышца) (фажжц)
Рис,
8.29. Упрощенная схема гликолиза.
3
Св, С) — шести - и трехуглеродные соединения, 1—4— реакции, определяющие кинетику процесса в це. том.
Здесь X, У, У — концентрации, vm — максимальная скорость реакции X X', Ки К2, Кі — константы, у — порядок ингибиро - вания фермента коферментом Y'. У + Y' = У0 — постоянная величина и имеется большой избыток X и Y', т. е. Х/Е, Y'/E » 1.
Введем безразмерные переменные vx_ , _ г_
KiK 1 V
V
Уо*
УУо
(8.91)
Б=
Р=
E =
V =
" Уо ' [5] А.
* _ V0Kx ' у
JU
K2 + k3 ' Vm
Ко '
Vm = •
Ay
(8.92)
■ v, — v,
У — V,
Y „ '
V0 = (k2+k3)Y, n
Vi = y
* 0
Кинетические уравнения имеют вид dx dx
Vt ( Кг У
КГ' а = (т7І'
Где
Хг/
V =
Vl=vm — px.
Квазистационарная скорость реакции v определяется из уравнения
V = T-T7#—тт^Г. (8.93)
I + у' (1 + at/y)
Где у' = б — v — квазистационарная концентрация кофермента.
![]()
0,5
1,5
2,0 2,5 t, vee:
Рис. 8.30. Колебания концентрации НАД-Н в экстракте дрожжей.
1,0
О
Из этих значений v и у' находим концентрацию субстрата
* = v + 1 + а (б - v)v) . (8.94)
, vz V'±==Y
Реакция с субстратным сливаются, образуя^ точку пере-
Выходные характеристики системы, т. е. значения х, находятся из уравнения (8.94) путем подстановки значений v, удовлетворяющих условию 0 < х < < б. Область существования S - образной нелинейности ограничена значениями параметров,
Скачкообразные переходы между стационарными состояниями (ср. [7]). Возникает также возможность генерации импульса реакции в ответ на надпороговое возмущение параметров. Наконец, возможны автоколебательные состояния. На рис. 8.32 показаны три стационарных состояния, отвечающих пересечению S-образной входной характеристики v(a:) с прямой vj = = vm — Р*- На рис. 8.33 показаны устойчивый и неустойчивый предельные циклы, окружающие неустойчивые стационарные состояния.
Юг
У(х)
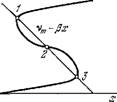
Рис. 8.32. Несколько стационарных состояний, возникающих вследствие нелинейности входной характеристики.
Сельков отмечает, что распространенное мнение о малых временных постоянных автоколебательных биохимических процессов ошибочно. Периоды колебаний порядка суток и больше возможны, например, если субстрат X может обратимо переходить в неактивную форму [81]. Соответствующий расчет приведен в [79].
Можно показать, что существует неограниченное разнообразие биохимических механизмов, подобных рассмотренной реакции и, тем самым, обладающих такой же нелинейностью. Такие модели рассмотрены в [79] (см. также [19]). Различные механизмы могут взаимодействовать друг с другом. Нелинейные системы являются регуляторными. Факторы, прямо или косвенно влияющие на стационарные состояния или воздействующие на основные нелинейности биохимических реакций, определяют их динамическое поведение. Даже малое изменение поступления субстрата может, например, привести к исчезновению автоколебательного режима и к исчезновению альтернативных стационарных состояний. Таким образом, основная нелинейность подлежит строгому контролю.
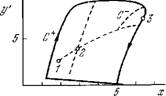
Рис. 8.33. Устойчивый (С+) и неустойчивый (С~) предельные циклы.
1, 2, 3— стационарные состояния. а=100, 13 = 0,08, 7 = 3,6 = 0,9, £ = 0,01, vm = 0,825.
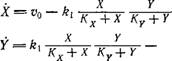
K2 к + у ■ j
![]()
Реакция гликолиза является ярким примером нелинейного биохимического процесса. Рассмотрим ее подробно, следуя за изложением в [18], основанным на работах Селькова (в частности, [82]) и Хиггинса [63]. Обратимся к схеме, показанной на рис. 8.29. Кинетика процесса в целом определяется несколькими «узкими местами», обозначенными на схеме цифрами. Обозначим через у0 скорость реакции 1, катализируемой ферментом гексокиназой (ГК). Реакция Cg+riCg' быстрая и обратимая, поэтому будем считать, что концентрации этих веществ пропорциональны друг другу— устанавливается квазиравновесие. Концентрация X одного из веществ Cg, С" возрастает со скоростью 1>о и убывает за счет реакции 2, катализируемой фосфофрукто - киназой (ФФК). Далее, вплоть до реакции 3, протекает несколько быстрых обратимых реакций и, следовательно, концентрации промежуточных веществ пропорциональны друг другу. Обозначим одну из этих концентраций через У. ФФК активируется продуктами своей реакции, т. е. веществом Y. Поэтому увеличение У за счет реакции 2 зависит как от X, так и от У. Скорость возрастания У равна скорости убыли X. В реакции 3, катализируемой пируваткиназой (ПК), У убывает. Получаем кинетические уравнения [63]
(8.95)
В работе Селькова [82] вместо множителя Y/(Ky-\- У) фигурирует Y2/(Ky Y2), т. е. вводится более высокий порядок активации ФФК, что обосновывается биохимически. Однако уже простая система (8.95) характеризуется интересующей нас нелинейностью, и результаты расчетов в работах [63] и [82] сходны друг с другом. Более того, автоколебательный режим получается и при дальнейшем упрощении, если принять, что Кх ^ X, Ky ^ Y. Получаем систему
(8.96)
Подобную системе Лотка (см. стр. 440). Здесь k[ = kyIKxKY, = k2/K. Очевидно, что Do пропорционально содержанию ГК, k[ — содержанию ФФК и ^—содержанию ПК- Стационарные концентрации X и У равны
Введем безразмерные переменные
V./k
Тогда (8.96) примет вид
Dx.
(8.97)
*Г=1-ХУ>
Dx аУ{х і +гу)'
Где
V*
V0 /К
Фазовый портрет системы на плоскости х, у и главные изоклины показаны на рис. 8.34. Изоклина вертикальных касательных (/) — гипербола у = х~\ горизонтальных касательных (//) — гипербола л; = (1 + г)/(1 + гу) и прямая у — 0. Линеаризуя уравнения (8.97), определяем характер особой точки О. Корни характеристического уравнения равны
Voki
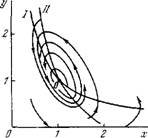
Рис. 8.34. Фазовый портрет колебаний при гликолизе. i, ii — изоклины.
1 + МО-
\2 4а 1'/»
Г) 1 +г J '
1 4-і
При 4а/(1 + г)>(1 — ar/( 1 + г))2 точка О есть фокус. Если аг/(\ + г)<0, фокус устойчив, если аг/(1 + г) > 0, фокус неустойчив и вокруг него возникает предельный цикл. При arl( \ + г) = 1 происходит бифуркация. Вблизи этой точки, если \аг/(\-\-г)—1|<С1, частота колебаний равна мнимой части корня характеристического уравнения, т. е.
V-
(0 :
1 +Г
(8.98)
Таким образом, при определенных условиях система (8.96) действительно дает автоколебания. Увеличение параметра а способствует их нарастанию, уменьшение а — затуханию. Из выражения для а следует, что уменьшение k[ и скорости притока £>о должно вызывать самовозбуждение колебаний. К тому же результату должно приводить увеличение^, т: е. добавка ПК. Это согласуется с опытом.