АВТОКОЛЕБАНИЯ ПРИ ФОТОСИНТЕЗЕ
Периодические процессы непосредственно проявляются в физиологии как животных, та'.с и растительных организмов. Речь идет прежде всего о процессах, связанных с вращением Земли вокруг ее оси, со сменой дня и ночи, таких, например, кал чередование сна и бодрствования В связи с этим было введено понятие биологических часов [66]. Хальберг назвал циркадными ритмами биологические колебания с периодом, близким к суточному [83]. Питтендрай перечисляет характерные особенности циркадных ритмов в статье [84]. Циркадные ритмы повсеместны в живой природе и имеют эндогенный и врожденный характер. Физическая причина циркадных ритмов лежит в автоколебательных процессах, периоды их практически независимы от температуры и от химических возмущений. Они автономны на клеточном и организменном уровне.
Наряду с циркадными, суточными, ритмами периодических изменений состояния всего организма в живой природе наблюдается ряд колебательных явлений с другой периодичностью, которые также следует отнести к категории биологических часов. Рассмотрим в качестве примера колебания интенсивности фотосинтеза. Ясно, что фотосинтез непосредственно связан с освещенностью. Скорости поглощения С02 и выделения 02 зелеными растениями также периодичны. По-видимому, периодичность, определяемая эндогенным ритмом, свойственна темповому циклу Кальвина (см. стр. 360), так как реакции светового цикла протекают очень быстро — за доли секунд. По-видимому, ритм, связанный с темновым циклом, характеризуется периодом, существенно меньшим суток. Однако этот ритм хорошо синхронизуется с периодической освещенностью.
Очевидно, что непосредственно наблюдаемый ритм фотосинтеза должен определяться периодическими биохимическими процессами темнового цикла. Мы видели, что периоды колебаний ферментативной активности могут быть и весьма длительными. Теоретическая модель колебаний в темновых реакциях Фотосинтеза разработана Чернавским и его сотрудниками [18, 85—87].
В цикле Кальвина участвуют трехуглеродные, нятиуглерод - ные и шестиуглеродные соединения (см. рис. 7.18). Написание всех кинетических уравнений для цикла приводит к системе, слишком сложной для исследования. Как справедливо указывается в [18], целесообразно максимальное упрощение системы, сохраняющее, однако, ее основные качественные особенности. Кинетика процесса лимитируется медленными стадиями, быст - p&w обратимые стадии могут рассматриваться как равновесные. Поэтому следует ограничиться рассмотрением лимитирующих стадий. В сущности, такая процедура уже применялась при ана - лпзе ферментативных реакций в §§ 8.6, 8.7. Упрощение. системі кинетических уравнений проводится на строгих математических основаниях. Рассмотрим их вкратце (ар. [18]).
Имеем исходную систему типа
Xi = Fi(xu *2. xN), t = 1, 2 iV, Ш)
Допустим, что после ряда преобразований и выбора соответ-: ствующих масштабов удается расположить эту систему по степеням малого параметра є при производной
Є2*, = F і (хи. . ., xN), г=1, 2, ...,/, Ї
Bx,^Fj(xu. . ., xN), j = l+\, ..., l + m, > (8.99) xk = Fk(xu. . ., xN), k = l + m+ 1, . . ., N.)
Коэффициенты є2 и є определяют скорости изменений переменных х. В самом деле, систему (8.99) можно переписать. в виде
Ті Тз
Где ті = є2, т2 = є, тз = 1, т. е. ті <С т2 <С т3. Если существенно' поведение системы как на малых отрезках времени порядка ti, так и на больших порядка тз, то приходится изучать систему в целом. В других случаях ситуация иная. Так, если важны явления, происходящие за средние времена порядка т2, то система' упрощается. В самом деле, за эти времена «медленные» переменные xh не успевают измениться, и можно заменить' их на-, чальными, постоянными значениями. Напротив, «быстрые» переменные Хі успевают достичь своих стационарных значений," если таковые существуют. Значит, переменные xt можно заменить их стационарными значениями. Таким образом, из N уравнений остаются лишь т уравнений.
Математическое обоснование процедуры связано с так называемой теоремой Тихонова (см. [18, 113, 114]). .
Вернемся к фотосинтезу. Чернавский и сотрудники ограничились здесь исследованием всего лишь двух кинетических уравнений. в которых в качестве независимых переменных фигурируют концентрации трехуглеродных и шестиуглеродных соединений С3, Сб. Остальные переменные выражаются алгебраически через С3, С6. Так как в цикле Кальвина протекают в основном бимолекулярные реакции, кинетика выражается уравнениями второго порядка
= a, q + a2c3c6 + a3c§. j (8 j00)
С^СІ + Р^ + РзС* j
В первом уравнении аз = О — концентрация триоз С3 не изменяется в результате взаимодействия двух гексоз. Увеличение Сб может осуществляться лишь за счет соединения двух молекул Сз. Следовательно, Pi > 0, р2, Рз < 0. Увеличение содержания триоз происходит в более сложном процессе, в котором участвуют как сами триозы, так и гексозы Сб - Можно положить осі > 0, аг < 0. Мы получаем уравнения
Рі^з Рг^з^б Рз^б> J
Где все коэффициенты ар, > 0.
Находим изоклины и стационарные состояния, отвечающие С3 = С6 = 0. Обе изоклины представляют собой прямые линии, проходящие через начало координат, их уравнения С6 = а[С3 и Сб — а2С3, где Я] и а2 удовлетворяют условиям а\ — а2а\ =0 и |3j — Р2а2 — рза2 = 0. Имеется лишь одно стационарное состояние C° = CJ? = 0 при й\ ф а2 или бесконечное множество таких состояний при й\ — а2. Первый случай соответствует отсутствию фотосинтеза, второй — безразлично неустойчивым состояниям равновесия. Предельных циклов нет, нет и колебаний. Следовательно, система (8.101) недостаточна, модель требует достройки. Чернавский вводит в первое уравнение добавочный постоянный член ао > 0, описывающий скорость притока С3, возникающего в других процессах, отличных от цикла Кальвина (гликолиз, дыхание). Такой приток служит инициатором цикла. Необходимость пускового механизма характерна для автокатализа. Итак,
= а1с3 — а2с3с6 + а0' 1
J (8.102) c6=P, q-P2c3c6-P3q. J
Исследуем эту систему уравнений. Перейдем к переменным Х = С3/С°3, У = С6/С°, где С» — стационарные значения С3, Сб, получаемые из условий С3 = С6 = 0. Имеем
X = а\Х2 — a2XY а0, )
- „ - - п ( (8.103)
У = РіХ — РзХУ — Р2У, J
Где а, а2 = а2С°, а0 = а0/С°, Р, = ftC^/Cg, Э3 = Р3Со
Р2 = Р2С«. В стационарном состоянии X = Y — 1, X = Y = 0. Следовательно,
«і — «2 + «о = 0, 1
. . . } (8.104)
Р,-Р2-Рз = 0. )
Далее опустим черту над буквами щ и |3j. В стационарном режиме коэффициент |3| представляет количество гексозы, образующейся в единицу времени из триозы, |3г — количество гексозы, уходящее из цикла Кальвина и образующее крахмал, |33 — количество гексозы, возвращающееся в цикл. Для ухода одной молекулы гексозы нужно шесть оборотов цикла, так как в цикле усваивается одна молекула СОг. Поэтому fb = Рз/6. Следовательно, р3 = 6|3i/7, |32 = |3i/7. С другой стороны, а0 «С «ь а. Имеем, вводя безразмерное время т = tjx' = a\t,
DX dx dY dx
Aj
(8.105)
Ил О2
Ai
Линеаризуем систему, рассматривая ее вблизи стационарного состояния, т. е. считая
Х=\+х, Y=l+y, х, у< 1.
Получаем из системы (8.105), исключив а2 с помощью первого соотношения (8.104),
(8.106)
Dx
Ж = (1-у)х-(\+у)у,
Dy 8 , .
Ж = тв{х-у),
16,
У7еу]'2. (8.107)
Где у = ao/ai
Є = Pi/aj. Ищем решения в виде х = х0ехр Хх, у = у0ехрХх. Находим корни характеристического уравнения К 2 = 7а (1 - Y - 8/?е) ± ['д (1 - Y - 8/7е)2 -
Стационарное состояние х = у — 0 устойчиво, если действительная часть X отрицательна, т. е. если
1 — Y — 8/7е < 0.
И неустойчиво в противоположном случае.
Переход к неустойчивому режиму происходит при е = = 7/e(1 — v) ~ 0,87 (так как!)• При увеличении at такой переход оказывается возможным.
Мнимая часть (8.107) определяет колебания. Их период (безразмерный) равен
2п
Т =
ІшЛ '
15 М. В, Волькенштейн
где
1т % = ± [16/7еу - (Re Я)2]7'. При переходе к неустойчивому режиму, когда Re К
Dy _ 2 *2 - Ч? у2 - ehxy dx З X2 — 21І20ХУ + V20 '
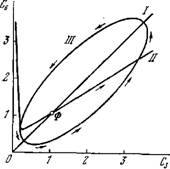
Рис. 8.35. Фазовый портрет для
Модели фотосинтеза [84]. i и ii—линии параллельных и перпендикулярных изоклин, iii—предельный цикл. Ф(Х = У = 1) — устойчивый фокус.
2л
Т =
Vl6/7eY
Поведение системы исследуется обычным методом «фазовых диаграмм. Положим для конкретности y ^ 1/20 и е » 2/3. Тогда
Условие неустойчивости соблюдается, так как
16
21 '
Интегральные кривые представляются уравнением
На рис. 8.35 показан фазовый портрет системы уравнений (8.106) при указанных значениях у и е. Система является автоколебательной, Сз и С6 периодически изменяются с одинаковой фазой. Численное или графическое определение периода колебаний С3 и С6 показывает, что он примерно на два порядка больше характеристического времени т'-^-а"1. Это время оценивается в 5—10 мин, период Т порядка нескольких часов или суток. Колебания ангармоничны: система проводит большую часть времени в области малых значений концентраций С3 и С6.
Машинные расчеты показывают, что система синхронизуется внешним периодическим воздействием (освещенность). При переходе от одного режима к другому фаза устанавливается медленно.
Более подробное исследование системы уравнений (8.106) выполнено в работе [87] (см. также [18]).
О, имеем
Очевидно, что приведенное рассмотрение максимально упрощенно и не позволяет еще сделать какие-либо количественные выводы. Однако упрощенный подход раскрывает физический смысл автоколебаний при фотосинтезе и показывает, как они могут синхронизоваться суточным ритмом.