Электронный Парамагнитный резонанс в биологии
Триплетиые возбужденные состояния в белках
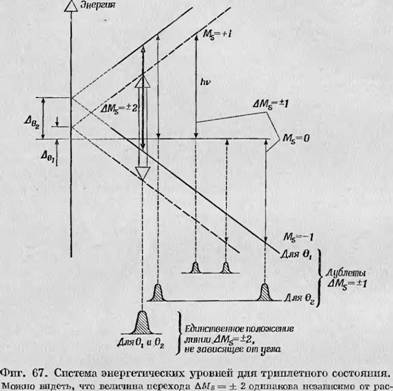
Работы по фотосинтезу привлекли внимание к изучению три - плетных возбужденных состояний в белках, и в настоящее время эта область исследования разрабатывается очень интенсивно. Общая характеристика триплетного возбужденного состояния и возникающий в этом случае сигнал ЭПР уже кратко обсуждались в разд. 1.4.2. Там было отмечено, что сильная анизотропия электронного расщепления приводит, как правило, к тому, что во всех случаях, за исключением монокристаллов, переходы AMS — +1 очень сильно смазываются и обнаружить их невозможно. Однако переход AMS = ±2, который не всегда является полностью запрещенным, соответствует одной и той же разности энергий независимо от угла между направлением магнитного поля и осью молекулярного поля. Это проиллюстрировано на фиг. 67, где показано,
|
Щепления в нулевом поле между состояниями Ms = 0 и Мя = ± 1. |
Что для самых различных значений углов разница энергий для переходов AMs — ±2 всегда постоянна. Возможность обнаружения такого перехода AMs = ±2 при использовании умеренных интенсивностей поля произвела переворот в исследовании три - плетных состояний биологических объектов, так как эти объекты крайне редко представляют собой монокристаллы и поэтому любой даваемый ими анизотропный спектр остается, как правило, неразрешенным. Возможность обнаружения триплетного возбуждения при таких двуквантовых переходах с помощью метода ЭПР была
<1 I
|
|
|
О 5 Ю 15 20 с |
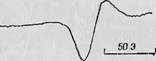
Фиг 68. Сигнал ЭПР, наблюдаемый для триплетного состояния глицил-I-
Т ринтофана [37].
А — кривая nepBojJ производной от линии поглощения полученная для расть. ра Ю-3 М глицил-г-триптофана, возбужденного светом с'дшшой волны 290 нм, щ)И 77 К; В — крАая гибели тришгетного состояния после выключения освещения.
|
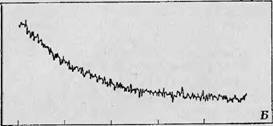
20 30 Брел. я.с Фиг. 69, Кривая фосфоресценции (/) и сигнал ЭП1 [II), характеризующие гибель триплетного состояния триптофана [37], Возбуждение проводилось светом с длиной волны 290 нм в растворе тршггос ана в фос- фатно-глицериновом буфере (1 : 1) при 7 К. |
|
50 |
|
40 |
|
10 |
Впервые продемонстрирована для стеклоподобного материала Ван - де-Ваальсом и Де Гроотом [34]; Итак и Дюзу в 1963 году [35] и Шига и Пьетт в 1964 году [36] исследовали триплетвые состояния ароматических аминокислот. Шига и Пьетт обнаружили триплет - ное возбуждение и в самих белках и подтвердили правильность интерпретации сигнала ЭПР, проведя одновременно измерение фосфоресценции.
За этой работой последовало множество других. Рассмотрим в качестве примера исследования Шиги, Мэзона и Симо [37]. Чтобы выяснить взаимосвязь между триплетным состоянием и лигандной системой, с одной стороны, и окислительным состоянием металлов в металлосодержащих белках — с другой, эти авторы изучали свойства триплетных состояний, наблюдаемых в белках и модельных соединениях. В этих экспериментах исследуемый раствор наливался в кварцевую трубку, охлаждался до температуры жидкого азота и помещался в резонатор спектрометра. Образцы освещались in situ через окошко в резонаторе светом от монохроматора, снабженного 200-ваттной ртутной лампой высокого давления. Одновременно с освещением записывался сигнал ЭПР и измерялась фосфоресценция, причем оба сигнала можно было подавать либо на двухлучевой осциллограф, либо, для повышения чувствительности, на подходящее интегрирующее устройство. Типичный сигнал ЭПР, получаемый в этом случае, показан на фиг. 68,А, а кривая затухания этого сигнала — на фиг. 68, Б. Сигнал обусловливается триплетным состоянием глицил-£-триптофапа в глицилфосфатном буфере (1 : 1); можно видеть, что он уменьшается вдвое за 4,5 с. Исчезновение сигнала ЭПР соответствует гибели самого триплетного состояния, в чем мояшо убедиться, сравнив кривую затухания ЭПР-поглощения с кривой фосфоресценции триплетного состояния. Такое сравнение сделано на фиг. 69, из которой можно видеть, что ход обеих кривых после выключения света одинаков.
Даже один этот пример ясно показывает, что метод ЭПР представляет собой мощное орудие для исследования триплетных возбужденных состояний в белках, с помощью которого мояшо детально выяснить механизм действия кислорода и ионов металлов. Так, в цитированной работе Шиги, Мэзона и Симо [37] было показано, что 1) при концентрации, превышающей некоторое критическое значение, происходит самотушение триптофановых триплетов; 2) природа растворителя по-разному влияет на время жизни триплетных состояний различных белков, что дает основание предполагать изменение конформации белка в этих случаях; 3) в - присутствии некоторых парамагнитных ионов, например иона двухвалентной меди, может произойти полное тушение триплетных возбужденных состояний; 4) кислород оказывает заметное действие на выход триплетных возбужденных состояний в гемоциа-
нине, причем оксигемоцианин дает меньший выход, чем дезокси - гемоцианин. В настоящее время проводятся исследования трип - летных состояний самых различных белковых молекул, и можно надеяться, что в этой области благодаря использованию метода ЭПР будет получено немало интересной и ценной информации.