Электронный Парамагнитный резонанс в биологии
Метод спин-меток
В разд. 7.1 уже упоминалось о том, что метод спин-меток был специально разработан для исследований биологических молекул. Этим он отличается от всех других методов ЭПР-спектроскопии, которые были разработаны ранее и использовались в самых разнообразных ЭПР-исследованиях, прежде чем их стали применять в биохимии. Метод спин-меток заключается в том, что вещество с известными парамагнитными свойствами присоединяют к большой биологической молекуле, а затем исследуют влияние нового окружения на спектр ЭПР этой спин-метки. Таким способом можно изучать ориентацию и природу химических связей вокруг свободного радикала, служащего спин-меткой, и с большой точностью обнаруживать наличие молекулярного движения. Метод спин-меток должен найти самое широкое применение в биологии и биохимии. В настоящий момент его широкие возможности только начинают привлекать внимание исследователей.
Метод спин-меток был разработан Мак-Коннеллом [17, 18], который впервые высказал идею о прикреплении стабильного синтетического органического свободного радикала к биологической молекуле и исследовал большое количество монокристаллов белков, меченных таким способом. В качестве спин-меток можно использовать самые разнообразные свободные радикалы, но они должны обладать некоторыми определенными свойствами: во-первых, радикал должен быть высокостабильным и, во-вторых, его спектр ЭПР должен изменяться в зависимости от ориентации, чтобы по виду спектра можно было определить ориентацию радикала в меченой молекуле.
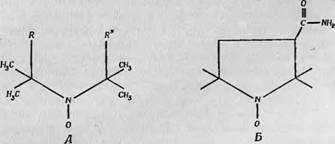
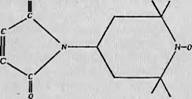
Мак-Коннелл и его сотрудники [17, 18] нашли, что наиболее удачным видом спин-метки являются свободные радикалы, содержащие группу N0 в соединении с третичными углеродными атомами. Структура такого свободного радикала показана на фиг. 121, А, где В и В* — группы, связывающие его с биологической молекулой. Эта связь может быть ковалентной, гидрофобной или какой-либо другой в зависимости от природы группы В. Одно из преимуществ радикалов этого типа заключается в том, что группы В и В* могут быть самыми разнообразными и, следовательно, спин-метка может быть прикреплена к самым различным аминокислотным боковым цепям или каким-либо другим участкам белковой молекулы. Основной проблемой в таких исследованиях является правильный выбор групп В и В* в каждом конкретном случае, чтобы спин-метка была присоединена к молекуле в наиболее удачном месте для получения наибольшей информации. В большинстве меток, применявшихся до сих пор, группы В и В* были соединены, так что образовывалось пяти - или шести- членное насыщенное кольцо (фиг. 121, Б).
|
Фиг. 121. Структура типичной спип-метки. |
|
В |
|
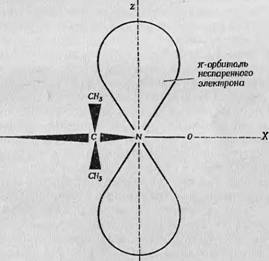
Л — основная структурная формула. В положениях Л и R* могут находиться самые разнообразные химические группы, используемые для связи с белком; Б — спин-метка, в которой две группы Л соединены с образованием кольца; В — распределение плотности неспаренного электрона по связям сгшн-метки. Атома азота группы N0; эта пространственная асимметрия обусловливает анизотропию G-фактора, значения которого Gx, Gy и Gz В этом случае равны 2,009, 2,006 и 2,0027 соответственно [19]. Сверхтонкое расщепление между тремя линиями, обусловленное взаимодействием с азотом, также анизотропно. Именно эти харак- |
На фиг. 121, В схематически изображена волновая функция неспаренного электрона этой спин-метки. Можно видеть, что неспаренный электрон локализован в основном на р-орбитали
|
|
Терные свойства спин-метки позволяют определять ее ориентацию по наблюдаемому спектру ЭПР.
Связь между спин-меткой и изучаемой молекулой может быть достаточно сильной и жесткой, так что группа N0 будет неподвижна относительно самой молекулы, или эта связь может быть совсем слабой, так что движение группы N0 вокруг связей будет довольно свободным даже в том случае, если остальная часть молекулы неподвижна. Этим двум разным типам связи и многочисленным промежуточным случаям соответствуют совершенно различные спектры ЭПР, так как молекулы с подвижной группой N0 дают спектры, похожие на спектры свободной спин-метки в растворе, в которых линии сужены за счет беспорядочного движения. В то же время биологические молекулы, содержащие неподвижные (заторможенные) группы N0, дают спектры ЭПР с широкими линиями, похожими на спектры, наблюдаемые на поликристаллических или порошкообразных образцах спин-метки. Следовательно, ширина наблюдаемых линий поглощения сразу говорит о природе связи метки с изучаемой молекулой и о внутримолекулярном движении.
В связи с этим следует отметить, что при исследовании очень крупных молекул белка в растворе весьма часто наблюдаются «сильно заторможенные спектры» (термин, применяемый для обозначения спектров, похожих на спектры твердых образцов и, следовательно, соответствующих малоподвижной группе N0). Это означает, что данная белковая молекула обладает жесткой структурой и что энергия ее собственного беспорядочного движения мала по сравнению с анизотропией энергетических уровней, наблюдаемой в спектре. С другой стороны, даже в тех случаях, когда сама биологическая молекула относительно неподвижна, спин-метка может давать узкие линии в спектре ЭПР. Это происходит в тех случаях, когда связь метки с молекулой такова, что допускается свобода вращения группы N0 вокруг одной из ее связей с белком. Поэтому при интерпретации спектров ЭПР, полученных методом спин-меток, следует соблюдать известную осторожность; в большинстве случаев очень полезно проводить измерения при разных температурах. Но если меры предосторожности приняты и проведено достаточное количество контрольных экспериментов, этот метод дает возможность получить очень ценные сведения как о движении биологической молекулы, так и о ее внутримолекулярных связях на различных специфических участках.
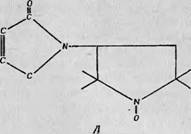
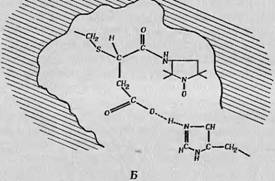
Для того чтобы показать, какого сорта информацию можно получить с помощью спин-меток, рассмотрим в качестве конкретного примера молекулу гемоглобина. Мак-Коннелл и сотр. [201 провели большую серию экспериментов на окси - и дезоксигемогло - бинах лошади, используя различные спин-метки. В первых экспериментах, в которых спин метку (фиг. 122, А) присоединяли к производным гемоглобина в растворе, наблюдались и «сильно заторможенные» и «слабо заторможенные» спектры ЭПР. Первые обладали примерно в 10 раз большей интенсивностью, и было показано, что они обусловлены спин-меткой, присоединенной к активным SH группам в р-цепях гемоглобина. Затормшкенность означает наличие определенных стерических ограничений, возможно связанных с раскрытием кольца (фиг. 122, Б). Дальнейшиз эксперименты проводились на монокристаллах гемоглобина лошади с использованием такой сильно заторможенной спин - метки, а также усовершенствованной спин-метки, структура которой показана на фцг. 122, В. Результаты, полученные в этих экспериментах - сводятся к следующему.
Прежде всего по ориентации «сильно заторможенной» спин метки моягао судить об ориентации той части молекулы, к которой она присоединена. Это было показано для кристаллов гемоглобина, в которых методом спин-меток была выявлена ось вращения второго порядка. Спектры ЭПР спин-меченых молекул очень* чувствительны к небольшим изменениям ориентаций, связанным с различными аминокислотными участками. Так, опыты со спин мечеными кристаллами оксигемоглобина лошади показали, что при присоединении спин-метки к SH-группе на участке [3-93 существуют, по-видимому, две возможные ориентации этой метки, несколько отличающиеся друг от друга (на 15°); Мак-Коннелл
[20] высказал предположение, что это объясняется существованием двух изомеров с разной ориентацией и, быть может, двух разных белков, которые, как известно, содержатся в гемоглобине лошади
[21] . Хотя для выяснения смысла этих небольших различий в спектрах ЭПР потребуется еще много работы, Кже сейчас совершенно ясно, что получен, очень чувствительный метод для изучения слабых конформационных изменении.
К биологической молекуле можно, конечно, присоединить не одну, а несколько спин-меток. Очень интересную дополнительную информацию дает, например, присоединение' спин-меток к двум различным аминокислотным остаткам, расположенным относительно близко в одной и той [же молекуле. Это позволяет наблюдать и диполь-дипольиое и обменное взаимодействие между двумя неспаренными электронами этих двух спин-меток и, следовательно, получать точные сведения о расстоянии между мечеными аминокислотами'и об их взаимной ориентации. Разумеется, можно себе представитй); множество модификаций этого метода. Нет никаких сомнений в том, что в ближайшие годы будет опубликовано много работ, которые проиллюстрируют разнообразные формы использования спин-меток для получения точных данных о структуре, химических связях и внутримолекулярном двиясе - нии в биохимических молекулах.
|
|
|
|
|
Фиг. 122. Спин-метка на молекуле гемоглобина. |
А — структурная формула спин-метки, Использовавшейся в первых"'экспериментах Мак^Кеннелла и с '"р [20], Б — предполагаемоекольца ' при присоединении спин-метки; В — структурная^ форму га усовершенствованной1! сшш-метки (малегмида).