Электронный Парамагнитный резонанс в биологии
Более поздние эксперименты
При дальнейшем изучении спектров ЭПР облученных белков и аминокислот Горди и Курита [7] попытались выяснить действительный механизм образования свободных радикалов и проследить за судьбой первичных и вторичных продуктов радиационного поражения. Полученные результаты подтвердили в общих чертах ранние работы Горди и др. [5]: стало ясно, что при облучении белков в вакууме при комнатной температуре наблюдаются сигналы двух основных типов — во-первых, хорошо разрешенный дублет, подобный тому, который наблюдался у шелка-сырца, и, во-вторых, широкий сигнал порядка 100 Э (при использовании длин волн Х-диапазона), соответствующий спектру, приписываемому, как уже было показано в предыдущей главе, атомам серы.
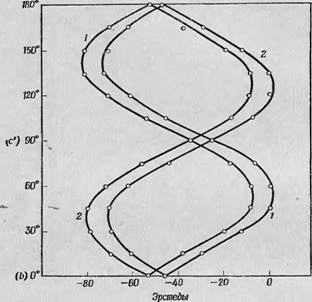
Для более тщательной проверки последнего предположения Горди и Курита [7] изучали подвергнутые - у-облучению монокристаллы цистиндигидрохлорида с целью точного измерения смещения g-фактора. При произвольном выборе направления магнитного поля наблюдалось два дублета (фиг. 55), которые сливались, когда магнитное поле было направлено вдоль кристаллографической оси Ъ или лежало в плоскости ас. Это означает, что оба дублета обусловлены одним и тем же свободным радикалом, по-разному ориентированным относительно осей кристалла. Кроме того, из фиг. 55 видно, что расщепление внутри каждого дублета не зависит от микроволновой частоты и, следовательно, вызывается сверхтонким взаимодействием, тогда как расстояние между дублетами зависит от частоты (при 23 ГГц оно значительно больше, чем при 9 ГГц). Таким образом, эти резонансные линии свидетельствуют о значительном сдвиге величины g'-фактора.
Резонансные значения поля, соответствующие двум сверхтонким компонентам этих двух дублетов при разных ориентг. циях магнитного поля в плоскости Ъс, представлены на фиг. 56 (измерения проводились при 9 ГГц; за нуль отсчета было принято резонансное значение магнитного поля, соответствующее g-фактору свободного электрона). Мояшо видеть, что экспериментальные
Точки (обозначены кружками) хорошо укладываются на теоретические кривые. На основании этих измерений (а также измерений в других кристаллографических плоскостях) Горди и Курита [7] заключили, что g-фактор для этих радикалов имеет следующие три основных значения: g-, "д^2,003. Gv = 2,029 и Gz = 2,052.
Такую сильную анизотропию g-фактора можно объяснить тем, что под действием подающего у-излучения разрывается S — S-связь в молекуле цистина и освобождается неспаренный электрон, который остается локализованным в значительной степени на атоме S. В пользу этого предположения говорит тот факт, что при облучении образуются два различно ориентированных радикала, хотя все исходные молекулы ориентированы одинаково. Если бы наблюдаемый резонанс был обусловлен трехэлектронной S — S-связыо, как предполагалось сначала, все свободные радикалы должны были бы иметь одну и ту же ориентацию. Разрыв же этой связи приводит к образованию двух фрагментов, которые могут ориентироваться по-разному.
Такую интерпретацию подтверждает также анализ сверхтонкой структуры. Для того чтобы установить, чем вызвано расщенление дублета — атомом водорода, связанным с углеродом, или же атомом водорода, связанным с кислородом или азотом,— этот спектр был сопоставлен со спектрами дейтерированных образцов. Известно, что атомы дейтерия замещают только протоны, связанные
|
Фиг. 56. Резонансные значения поля для двух сверхтонких компонент двух дублетов 1 и 2 и спектрах цистиндигидрохлорида, подвергнутого у-облу - чению (см. фиг. 55), в зависимости от направления внешнего магнитного поля В плоскости Ъс [7]. За нуль отсчета принята'величина G = 2,0036 (^-фактор ДФПГ). |
С кислородом или азотом, но не с углеродом. Так как никакого видимого изменения спектров при дейтерировании не наблюдалось, был сделан вывод, что протон, участвующий во взаимодействии, связан с углеродным атомом. Из этого следует, что волновая функция неспаренного электрона, локализованного в основном на атоме серы, перекрывается, по-видимому, с волновой функцией протонов соседней СН2-группы (сверхсопряжение), в результате чего и возникает наблюдаемый дублет с расщеплением около 10 Э.
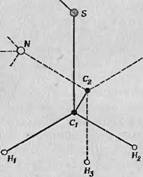
Конечная ориентация образующегося свободного радикала показана на фиг. 57.
Мы подробно проанализировали эти частные результаты потому, что они ясно показывают, насколько полезнее исследовать монокристаллы, чем pt створы (если, конечно, исследуемое вещество можно получить в виде монокристалла); эти результаты позволяют сделать окончательный вывод о причине значительного смещения '/-фактора, наблюдаемого у многих облученных белков,
|
|
Если смещение g-фактора для монокристалла известно, то можно предсказать форму линии и для поликристаллического образца,
|
|
А Б
Фиг. 57. Изменение ориентации сьободных радикалов, образовавшихся в цистиндигидрохлориде под действием у -облучения [7].
— структурная формула^деповрежденной мстскулы; Б — структурная формул; свс бодно: J радикала с измененной орлеитацией. разрыв связи Sit - S позволяет атому серы певемес иться вниз налево (соответственно изменяются положения атомов Нi и Н2).
Содержащего те же свободные радикалы, но ориентированные беспорядочно относительно направления внешнего магнитного поля. Такой теоретический расчет был проведен в общем виде Кнёбелем [8]. В конкретном случае кристаллов цистиндигидро - хлорида среднее значение g-фактора получается равным 2,028. Таким образом, данные экспериментальных исследований на монокристаллах и их экстраполяция на поликристаллические препараты подтверждают, что главной отличительной чертой свободных радикалов, образующихся при у-облучении с-ерусодержащих белков, действительно является локализация неспаренного электрона на атомах серы (но, по-видимому, не на трехэлектронной S — S-связи, как предполагалось вначале).
В тот А^е период был выполнен ряд работ по выяснению природы сверхтонкого расщепления в дублете, которое наблюдается при рентгеновском облучении дипептидов и полипептидов. Аиали-
зируя свои более поздние работы, Горди с сотр. [9] предположили, чтоу£тот дублет] обусловлен локализацией неспаренного электрона на каком-то одном протоне, находящемся в остове белковой молекулы, а не взаимодействием с протоном, осуществляющим поперечную водородную связь, как предполагалось ранее. При исследовании поликристаллического или аморфного материала всегда трудно однозначно интерпретировать спектры ЭПР. Как было показано для случая цистичдигидрохлорида, при изучении монокристаллов можно получить значительно более определенную и специфическую информацию.
К настоящему времени исследованы монокристаллы малоновой [10], янтарной [11] и глу таминовой кислот, глицина [12, 13] и сМ-алашша 114]. Группа
Горди продолжает проводить систематические исс ледов анчя монокристаллов белков и аминокислот, входящих в их состав. Сравнение этих спектров и теоретический прогноз их структуры при усреднении всех вероятных направлений дают осно-
Цепи и что эти радикалы, по всей вероятности, образуются на всех аминокислотных остатках при отрыве боковой цепи. Хенриксен и др. [15] высказали предположение, что неспаренный электрон локализуется на остатке глицина, поскольку в этом случае для образования свободного радикала должен> произойти отрыв только одного атома водорода.
Результаты всех этих исследований можно резюмировать следующим образом. Конечным результатом рентгеновского облучения белков является образование радикалов типов I и II (фиг. 58) В серусодержащих белках образуются радикалы тина I, для которых характерно смещение g-фактора, обусловленное взаимодействием с атомом серы; при прямом взаимодействии протона с неспаренным электроном, локализованным на белковом остове, образуются радикалы типа II, спектр которых имеет вид дублета. Исследования полиаминокислот [16], подвергнутых рентгевовскому облучению, показывают, что в этих случаях иногда образуются радикалы двух других типов — III и IV
По-видимому, радикалы типа III возникают также и при рентгеновском облучении белков, тогда как доказательства существования радикалов типа IV получены только на аминокислотах. Результаты подробных исследований Паттена и Горди [9] на эту тему сведены в табл. 1.
Таблица 1
Типы радикалов, образующихся при рентгеновском облучении [9J
|
Белок или поли- аминокислота |
Содержание аминокислот |
Другие остатки |
Типы радикалов |
||||||
|
Ала - иин |
Глицин |
Цис - Тин |
Цис - теин |
I |
II |
III |
IV |
||
|
Полиглицин |
100 |
X |
|||||||
|
Полиалашш |
100 |
X |
|||||||
|
Полилейцин |
Лейцин |
X |
|||||||
|
Полиглутаминовая |
Глутаминовая |
X |
|||||||
|
Кислота |
Кислота |
||||||||
|
Полицистин |
100 |
X |
|||||||
|
Желатина |
8,0 |
23,0 |
0 |
0 |
X |
X |
|||
|
Коллаген |
8,2 |
23,0 |
0 |
0 |
X |
X |
|||
|
Лолиаснарагино- |
Аспарагиновая |
||||||||
|
Вая кислота |
Кислота |
X |
|||||||
|
Гистон |
68 |
5 |
0 |
0 |
X |
X |
|||
|
Казеин |
2,9 |
1,8 |
0,3 |
0 |
Лейцин 14%, |
X |
X |
X |
|
|
Глутамино |
|||||||||
|
Вая кислота |
|||||||||
|
20% |
|||||||||
|
Зеин |
94 |
0 |
0,8 |
0 |
X |
X |
|||
|
Эдестии |
4,0 |
0 |
0,9 |
0,5 |
X |
X |
X |
||
|
Глиадин |
2,0 |
0 |
0 |
2,5 |
X |
X |
X |
X |
|
|
Пенсии |
0 |
5,8 |
1,5 |
0,5 |
X |
X |
|||
|
Яичный альбумин |
6,3 |
2,8 |
0,5 |
1,2 |
X |
X |
X |
||
|
Химотрипсиноген |
4,9 |
5,3 |
2,8 |
0,9 |
X |
X |
X |
||
|
Лнзоцнм |
5,3 |
5,2 |
6,2 |
0 |
X |
X |
X |
||
|
Бычий альбумин |
5,6 |
1,6 |
5,1 |
0,3 |
X |
X |
X |
||
|
Рибоиуклеаза |
0 |
1,2 |
6,2 |
0,6 |
X |
X |
X |
Спектр, обусловленный радикалом типа III (нолн-Z-алаиип), представлен на фиг. 59 (там же для сравнения показан более часто встречающийся дублетный спектр). Так как в радикале поли-Z - аланина неспаренный электрон должен взаимодействовать с тремя эквивалентными протонами метильной группы, при облучении, как и следовало ожидать, появляется квартетное сверхтонкое расщепление.
Для проверхш высказанного выше предположения о происхождении этих свободнорадикальных сигналов и сигналов, наблюдаемых в экспериментах на белках, было проведено прямое сравнение сигналов, полученных на самих белках, с сигналами, получаемыми на смесях аминокислот, взятых в тех же пропорциях, что
и в данном белке. Эти исследования Паттен и Горди [17] проводили в строго контролируемых условиях температуры и давления - Аналогичные исследования провели на фибриллярных белках Полит с сотр. [18], которые изучали смеси твердых растворов различных аминокислот.
К настоящему моменту эти исследования достигли уже такой стадии, когда для многих белков можно определить вероятное
Место и локализацию неспаренного электрона и сво- боднорадикальной активности.
|
Жет, |
Таким образом, несмотря на то, что эти спектры, полученные на твердых веществах, состоят из широких линий, трудных для: идентификации и анализа, такого рода исследования могут дать весьма значительное количество информации. Эти результаты можно сравнить с недавними работами Рейса и Уайта [19], которые использовали третированный сероводород для «перехвата» свободных радикалов, образующихся в данных условиях облучения, и таким образом определяли их распределение вдоль углеродной цепи. Эти эксперименты показали, что возникновение свободных радикалов мо - по-видимому, происходить на различных аминокислотных остатках, входящих в состав белковой цепи, и что, вероятно, доля свободных радикалов, образующихся на глицине, совсем не так высока, как предполагалось вначале на основании анализа ЭПР-спектров.