Электронный Парамагнитный резонанс в биологии
Атомные орбитали и энергетические уровни в атомах переходной группы
Как отмечалось в гл. 1, основное отличие атомов переходной группы от свободных радикалов заключается в том, что их неспаренные электроны локализуются в основном на атомных орбита - лях, тесно связанных с данным атомом, и, следовательно, спин - орбитальная связь весьма значительна. Вследствие этого значение g-фактора сигнала ЭПР атомов переходной группы сильно отличается от g-фактора свободного электрона и содерндаг в себе подробную информацию о природе химической связи того атома, которому принадлежит неспаренный электрон. Если атом переходной группы полностью свободен и не испытывает влияния электростатических полей со стороны кристаллической решетки или молекулярного окружения, то g-фактор неспаренного электрона должен определяться фактором расщепления Ланде (уравнение 1.10). Такие свободные атомы были получены в парах металлов, и их исследование методом ЭПР подтвердило справедливость уравнения (1.10) [1, 2]. Однако в огромном большинстве случаев, встречающихся и в физике, и в химии, и в биохимии, интересующие нас атомы переходной группы находятся не в свободном состоянии, а прочно связаны либо с кристаллической решеткой, либо с молекулой. В этих случаях на них действуют сильные электростатические поля, влияющие, в частности, на орбитальное движение электрона. Эти поля могут вызывать значительное отклонение величины g-фактора от его величины в свободном атоме.
Хотя, конечно, в этой книге нет смысла излагать полную теорию анизотропии g-фактора и его зависимости от величины и симметрии внутренних электростатических полей, необходимо, чтобы читатель имел о ней хотя бы общее качественное представление, так как в противном случае он не сможет понять смысла исследований но металлоорганическим соединениям. Начнем с рассмотре-
|
|
|
|
|
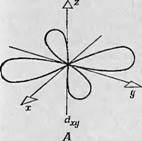
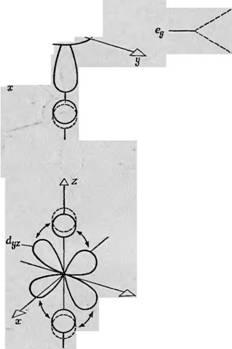
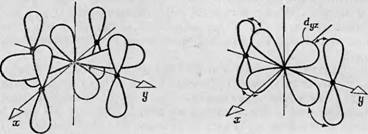
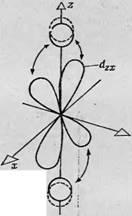
Фиг. 88. Зй-орбитали в свободном атоме. Доказана ростран^твенная ориентация пяти независимых Зй - орбиталей ю отношению к трем взаимно тсрпендйкулярным ослм. В случаях 4 — В лепе< гни рбнталей пересекают оси. в случаях Г и Д направлены вдоль о 'ей. |
|
Д |
Пия пространственной ориентации волновой функции электронов в атомах переходной группы и влияния внутренних молекулярных нолей на энергетические уровни, обусловленные пространственной ориентацией. В большинстве своем изученные к настоящему времени атомы переходной группы принадлежат к первой переходной группе, т. е. их электроны находятся на Зй-орбиталях. Следовательно, рассмотрение влияния внутренних молекулярных полей на орбитали сводится к обсуждению их влияния на Зй-орбитали. На фиг. 88 изображены Зй-орбитали в свободном атоме. Для каждого неспаренного электрона доступны пять Зй-орбиталей, которые можно охарактеризовать, взяв за основу ориентацию их лепестков по отношению к трем взаимно перпендикулярным осям х, у и z. Первая орбиталь (Dxy) имеет четыре лепестка, пересекающие оси х и у. Орбитали D,JZ и Dzx также состоят из четырех лепестков, но ориентированных так, что они пересекают оси У и z и оси z и х соответственно. Четвертая орбиталь получается при вращении йж;/-орбитали в плоскости ху, так что четыре лепестка располагаются вдоль осей х и у (фиг. 88, Г). Пятая орбиталь (фиг. 88, Д) состоит из двух лепестков, направленных вдоль оси z, и кольца, расположенного в плоскости ху.
Очевидно, что четыре из этих пяти орбиталей идентичны и отличаются только ориентацией в пространстве по отношению к осям координат. Пятая орбиталь имеет другую форму потому, что ее ось Oz является осью квантования. Если просуммировать электронные плотности, распределенные по всем пяти орбиталям, должна получиться сфера, соответствующая заполненной электронной оболочке. В отсутствие внешних электрического и магнитного полей нельзя выделить в пространстве такие направления, с которыми можно было бы связать какие-либо три оси х, у и z; следовательно, в свободном атоме все пять орбиталей вырождены, т. е. обладают одинаковой энергией. Если, однако, в каком-то определенном направлении приложено электрическое или магнитное поле, то каждая из пяти орбиталей примет свойственную ей ориентацию по отношению к этому направлению и ее энергия либо уменьшится, либо увеличится.
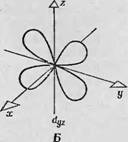
Рассмотрим в качестве примера атом переходной группы, окружение которого обладает кубической симметрией: шесть лигандных атомов расположены попарно на равном расстоянии от данного атома по осям х, у, z (фиг. 89).
В нервом приближении электронное облако вокруг каждого лигандного атома можно принять за электрически заряженную сферу. Ясно, что распределение электронной плотности на этих шести лигандных атомах и на Dx2~У2- и с/^-орбиталях таково, что отталкивание между ними должно быть существенно более сильным, чем между лигандами и тремя другими орбиталями. Действительно, четыре лепестка из-орбитали направлены непосред - ствеино к четырем атомам, лежащим на осях х и у, и, следовательно, отталкивание менаду ними весьма значительно. Точно так же два лепестка й2г-орбитали направлены к двум атомам, лежащим на оси z. Следовательно, для помещения электронов
|
А Б |
А Энергия
---------------------------------------------------------- j. De или е.
---------------------------------------------------------- Л г ( £
Dxi,
Dp I Dj или Tzg
Dxx J
Б
Фиг. 89. Атом переходной группы в окружении лигандных атомов, образующих октаэдр (кубическая симметрия). А — взаимодействие между й;с2_^г-орбиталыо и четырьмя лигандными атомами, расположенными на осях ас и у; Б — взаимодействия между с/22-орбиталыо и двумя лигандными атомами, расположенными на оси г В — расщепление Зсг-уровней, обусловленное
Этими взаимодействиями.
На эти две орбитали требуется больше энергии, чем для помещения их на три другие, у которых лепестки электронной плотности далеки от лигандных атомов и потому отталкивание отсутствует. Иначе говоря, в рассматриваемом случае пять орбиталей неспарен-
14—1182
|
|
|
Следовательно: |
|
Сближение лавандных атомов приводит к увеличению взаимодействия с Dzz-Opdurnaflbio |
Следовательно: Dy2 и D
Б
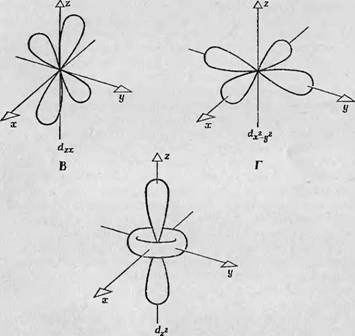
Фиг. 90. Влияние тетрагонального искажения кубической симметрии поля. Тетрагональное искажение обусловлено сближением двух лигандных атомов, расположенных на оси г. В результате возникает добавочное взаимодействие этих лигандных атомов с Зй-орбиталями атома переходной группы. А — добавочное взаимодействие между сближенными лигандными атомами и сг22-орбиталыо; Б — взаимодействие
|
Сближение лигандных атомов лриоойит к Увеличению взаимодействия с DyZ- и DZJr орбиталями |
С dyz- и dzx-орбиталями.
"ого электрона разделяются на две группы: dx-x_v2 - и йг2-орби - тали (эту группу часто называют Dt- или е^-группой), энергия которых увеличивается, и Dxy~, DlJZ- и йгж-орбитали (Dy~ или /з^-группа), энергия которых уменьшается. На фиг - 89, В показано окончательное распределение энергетических уровней. Разделение орбиталей на две группы под действием электростатического поля в случае кубической симметрии окружающих лигандных атомов представляет собой один из основных эффектов, вызываемых таким молекулярным окружением. Если расположение окружающих лигандных атомов имеет не кубическую, а тетраэдральную симметрию, как, например, в решетке алмаза, тогда влияние внутреннего поля на эти две группы орбиталей будет прямо противоположным. К окружающим лигандным атомам будут направлены лепестки Dxy~, D1JZ- и с4а-орбиталей, a DX2—VА - и ^-орбитали будут расположены в направлении нулевой электронной плотности лигандов.
На практике во всех кристаллах или молекулах симметрия поля не является строго кубической или строго тетраэдральной, а всегда несколько искажена, и это искажение сказывается в небольшом сдвиге одной из пар лигандных атомов. На фиг. 90, А показано искажение кубической симметрии, обусловленное сближением двух лигандных атомов, лежащих на оси Oz, в результате чего эти лиганды располагаются несколько ближе к центральному атому переходной группы, чем четыре лигандных атома, расположенные на осях х и у. Ясно, что в этом случае отталкивание между е^-орбнталью и лигандами, расположенными по оси Oz, выражено гораздо сильнее, чем раньше, и, следовательно, энергия йг2-орби - тали возрастает еще больше. Б то же время между лепестками dX2-y2- орбитали и четырьмя лигандными атомами, расположенными в плоскости ху, добавочного отталкивания нет, и потому энергия не возрастает. Следовательно, такое добавочное тетрагональное искажение кубической симметрии поля приводит к расщеплению уровня группы ее. При уменьшении расстояния между двумя лигандными атомами по оси z несколько увеличивается также и отталкивание между ними и лепестками орбиталей D]JZ и Dzx, Тогда как четыре лепестка d^-орбитали не затрагиваются. Иначе говоря, между орбиталями группы t2g также возникает расщепление. Таким образом, электростатические молекулярные поля с более низкой симметрией вызывают в обеих группах орбиталей добавочное расщепление.
До сих пор мы считали, что распределение электронной плотности вокруг лигандных атомов имеет вид простой сферы. Однако в большинстве органических соединений, помимо а-связи, имеется и я-связь; поэтому в лигандных атомах электронная плотность бывает довольно высокой не только на сферических s-орбиталях, но и на р-орбиталях, и взаимодействие с этими орбиталями нужно
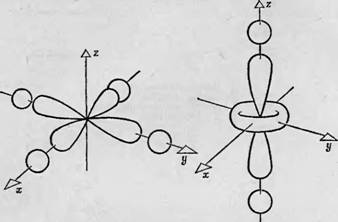
учитывать. На фиг. 91 рассмотрено взаимодействие d-орбиталей центрального атома с четырьмя из шести лигандов, одинаково расположенных по осям х, у, z; р-орбитали каждого лиганда обозначены двумя лепестками. Предполагается, что плоскость ху Соответствует плоскости рассматриваемой молекулы, например плоскости гема или порфиринового кольца в молекулах цитохрома, каталазы, пероксидазы или гемоглобина. В этом случае р-орби - тали расположены перпендикулярно плоскости ху, т. е. параллельно оси Oz; можно видеть, каким образом эти орбитали влияют на энергии трех орбиталей группы Tzg.
|
Az Az
Фиг. 91. Взаимодействие с р-орбиталями лигандных атомов, расположенных в плоскости ху (плоскость молекулы). Показано взаимодействие р-орбиталей четырех лигандных атомов с Лху- и й^г-орбита - лями. Можно видеть, что йзд-орбиталь расположена в плоскости, не содержащей р-орби - талей (А), тогда как между р-орбиталями и йда-орбиталью имеет место добавочное взаимодействие (В). Б |
|
А |
Лепестки dxy-o рбита л ей, находящиеся в плоскости ху, лежат в направлении, в котором р-Лепестков окружающих лигандных атомов нет; поэтому энергия этого уровня не зависит от р-орбита - лей и от л-связи (фиг. 91, А). В то же время лепестки с? у2-орбитали располагаются в этом случае в непосредственной близости к р-ор - биталям лигандных атомов, находящихся на оси у (фиг. 91, Б). Следовательно, между ними имеет место дополнительное отталкивание, так что энергия ^-орбитали возрастает. Точно так же обстоит дело с лепестками й23С-орбитали. Таким образом, под действием р-электронов, принадлежащих четырем атомам, расположенным в плоскости ху, группа уровней T2G в свою очередь разделяется на более низкий уровень, соответствующий Dxy-Орбитали, и более высокий, содержащий Dzx- и с^-орбитали.
Перейдем теперь к взаимодействию с р-Лепестками двух лигандных атомов, расположенных по оси z. Ориентация этих р-орбита - лей определяется участками молекулы, лежащими вне плоскости ху. На фиг. 92, А и Б показаны случаи, когда р-орбиталь
параллельна осям хну соответственно. В первом случае йгзс-орби - таль испытывает добавочное отталкивание, обусловленное близостью ее лепестков к р-орбитали, параллельной оси х; во втором случае дополнительное отталкивание испытывает уже dxy-oj)6n- Таль и, следовательно, возрастает именно ее энергия. Из этого качественного анализа следует, что расположение энергетических уровней в группе t2g определяется ориентацией р-орбитали лиганд - ного атома, лежащего на оси Oz. Зная порядок энергетических
A z
|
AZ
|
Фиг. 92. Взаимодействие с р-орбиталями лигандных атомов, расположенных
На оси Oz.
А — при ориентации р-орбитали параллельно оси Ох добавочное взаимодействие испытывает (Ijcz-орбиталь; Б ■— возникающее при ориентации р-орбитали;- параллельно оси Оу добавочное взаимодействие испытывает Dyz-орбиталь.
Уровней в группе t2g, можно получить точную информацию о структуре молекулы. Более подробно этот вопрос будет рассмотрен при обсуждении ЭПР-исследований гемоглобина.