Коррозия и коррозионная защита
Под коррозией понимают разъедание и разрушение материалов вследствие химических или электрохимических процессов с участием коррозионных агентов, например воды и воздуха.
2.16.5.1. Коррозия
Химическая коррозия: при химической коррозии металлические материалы химически изменяются снаружи благодаря действию кислорода (окислению) без участия воды. Газы и пары, прежде всего при высоких температурах, могут ускорить процесс.
Это окисление нельзя путать с окислением цветных металлов, при котором на поверхности образуется толстый защитный оксидный слой.
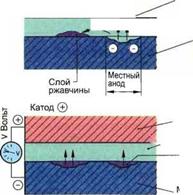
Электрохимическая коррозия: различают электрохимическую коррозию с кислородной деполяризацией влажных стальных поверхностей и электрохимическую коррозию на коррозионных элементах (рис. 2.200).
Электрохимическая кислородная коррозия происходит особенно на нелегированных или низко - Рис. 2.200. Коррозия металлов
|
Кислород из воздуха 02 |
|
Анод 0 |
|
Рис. 2.201. Электрохимическая коррозия |
|
|
|
Растворенные Fe-ионы |
|
{ ) { ) { / /V л FeOTT |
|
Пленка влаги Сталь (Fe) |
|
Метал 1, напр. Си ^ Электролит Анод растворяется, то есть коррозирует |
|
Золото |
+1,5 В |
||
|
>s _Q - X з CL -- о 03 |
Платина |
+0,86 В |
|
|
-- Ю <D CD -- Ш О LQ |
|||
|
Серебро Медь |
+0,80 В +0,34 В |
||
|
-- |
Водород |
ОВ |
|
|
Свинец, олово |
-0,13 В |
||
|
-- |
Никель |
-0,23 В |
|
|
Железо |
-0,44 В |
||
|
Xdom |
-0.56 В |
||
|
Цинк |
-0,74 В |
||
|
>s л X -- d о |
Магний |
-1,10В |
|
|
о го ё ф а> X -- а> .. 5 |
Алюминий |
-1,67 В |
|
|
„ Ж. |
|
W |
|
+1,6 Вольт +1,4 +1,2 +1,0 +0,8 +0,6 +0,4 +0,2 0 -0,2 -0,4 -0,6 -0,8 -1,0 -1,2 -1,4 -1,6 -1,8 |
|
|
|
Си |
|
Рис. 2.202. Электрохимический ряд напряжений |
|
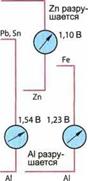
легированных сталях. Когда стальная поверхность покрыта влажной пленкой, то под влиянием кислорода из воздуха железо растворяется. Образуются ионы железа, которые в результате химической реакции с кислородом из воздуха образуют гидроокись железа Fe(OH)3, из которой образуется гидрат окиси железа FeO(OH), так называемая ржавчина. Электрохимическая коррозия на коррозионных элементах базируется на тех же процессах, которые протекают в гальваническом элементе (см. 14.3.3). В этой коррозии участвуют два различных металла или более, между которыми находится проводящая жидкость типа воды, так называемый электролит. При таком расположении неблагородный металл растворяется, то есть говорят, что он коррозирует или разрушается. В состоящем из цинка и меди гальваническом элементе медь является «более благородной» чем цинк, поэтому цинк разрушается. Если сравнивать металлы с электрически нейтральным водородом, то можно увидеть, что между водородом и металлами возникает электрическое напряжение различной величины. Эту разницу в напряжениях можно представить в виде электрохимического ряда напряжений или потенциалов (рис. 2.202). С помощью этого ряда напряжений можно рассчитать напряжение для каждого гальванического элемента. Например, элемент из меди и цинка дает 1,1В. Металлы, которые образуют положительный полюс, обозначаются как благородные металлы, те, которые образуют отрицательный полюс, — как неблагородные металлы. Чем дальше металл удален от водорода в ряду потенциалов, |
тем благородней (+) или неблагородней (—) он является. Чем дальше металлы одного гальванического элемента расположены друг от друга в ряду потенциалов, тем быстрее будет разрушаться менее благородный металл.
На основе этих данных можно предотвратить коррозию применением таких металлов, которые в ряду потенциалов расположены близко друг к другу, то есть медь, например, не должна крепиться оцинкованными стальными шурупами. Наряду с этим существует возможность предохранения областей контактов между различными металлами с помощью непроводящего промежуточного слоя, например покрытия, который исключает возможность попадания токопроводящей влаги непосредственно на области контактов.