ТЕХНОЛОГИЯ КОНДИТЕРСКОГО ПРОИЗВОДСТВА
Пересыщенные растворы сахарозы
В зависимости от концентрации сахарозы (при постоянной температуре) растворы могут быть ненасыщенными, насыщенными и пересыщенными. Они представляют собой однофазное вещество, отличающееся по концентрации и структуре. В ненасыщенном растворе молекулы сахарозы наиболее полно гидратированы и удалены друг от друга. В пересыщенном степень гидратации снижается, молекулы сахарозы более тесно расположены друг к другу, поэтому под действием сил межмолекулярного взаимодействия возможно образование ассоциатов из многих молекул.
Если в ненасыщенный раствор добавлять кристаллы сахарозы, то они будут растворяться. В насыщенном растворе между твердой и жидкой фазами устанавливается динамическое равновесие. В таком растворе процессы растворения и кристаллизации протекают с одинаковыми скоростями, поэтому количество растворенного вещества остается при данной температуре постоянным.
Раствор, содержащий растворенного вещества больше, чем в насыщенном, называется пересыщенным. Последний можно получить несколькими способами. Наиболее часто используют выпаривание при постоянной температуре растворителя или охлаждение насыщенного раствора. Так как при понижении температуры растворимость многих веществ, в том числе и сахарозы, снижается, то раствор из ненасыщенного переходит в пересыщенное состояние. И наконец, в насыщенный раствор можно добавить вещество, снижающее растворимость сахарозы, например, спирт, который связывает молекулы воды, вытесняя при этом молекулы сахарозы из раствора.
Степень пересыщения измеряется коэффициентом пересыщения, под которым понимается число, показывающее, во сколько раз в данном растворе на единицу массы'воды приходится растворенного вещества больше, чем в насыщенном при той же температуре:
а = Н / Н,, (IV-1)
где а - коэффициент пересыщения; Н - количество растворенного вещества на единицу массы воды в исследуемом растворе; Hj - количество растворенного вещества на единицу массы воды в насыщенном растворе при той же температуре.
Для пересыщенных растворов, очевидно, будем иметь а> 1, для насыщенных - а= 1, для ненасыщенных - а< 1. Для растворов чистой сахарозы Н,=Н0, т. е. растворимости при данной температуре. Если в растворе сахарозы присутствуют другие растворенные вещества, то Н1=Н0 а'. Тогда коэффициент пересыщения определяется по формуле
а = Н / Н0 а', (IV-2)
где а' - коэффициент насыщения.
Расчет коэффициента пересыщения ведется следующим образом. Предположим, что в помадном сахаро-паточном сиропе, охлажденном до 70°С, содержание сухих веществ по рефрактометру равно 88%, а содержание сахарозы С, определенное методом инверсионной поляризации, равно 72%. Находим содержание несахаров Н =88-72=16% и содержание воды В= 100- 88=12%. Тогда отношение Нс/В=1,3. Пользуясь графической зависимостью а' от Нс/В, из литературных источников находим значение а'-0,12. По таблице растворимости сахарозы при 70°С Н0=3,205; определяем Н:
Н = Сх / (100-СВ) = 12112 = 6,00.
Тогда
а = 6,00/3,205-0,72 = 2,61.
В теории кристаллизации степень пересыщения раствора может характеризоваться величиной абсолютного пересыщения:
а,=С-С, (IV-3)
где С - концентрация растворенного вещества; С _ - концентрация насыщенного раствора при той же температуре.
О степени пересыщения можно судить также по величине относительного пересыщения:
а2 = (С-С)/С =а,/С, (IV-4)
или по величине пересыщения, выраженного отношением
а = С/С =а,+ 1 =а./С + 1. (IV-5)
3 н 2 1 н v 7
259
Пересыщенные растворы сахарозы неустойчивы, однако при небольшом пересыщении они могут оставаться без изменений в течение того или иного промежутка времени. Как долго может продолжаться это состояние, зависит от степени отклонения раствора от состояния равновесия и от природы и свойств веществ, образующих раствор. Переход из неравновесного состояния в равновесное сопровождается кристаллизацией избытка растворенного вещества.
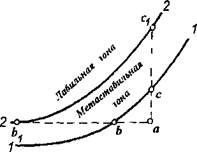
Для выяснения пределов устойчивости пересыщенного раствора рассмотрим диаграмму его состояния в координатах концен - трация-температура (рис. IV-1).
Пусть в выбранной системе координат точка а характеризует концентрацию и температуру ненасыщенного раствора.
|
Рис. IV-1. Диаграмма состояния растворов сахарозы |
Такой раствор будет оставаться однофазным неопределенно длительное время, но он неустойчив. При добавлении в такой раствор кристаллов сахара они быстро растворяются. Раствор с параметрами в точке а можно перевести в равновесное насыщенное состояние двумя способами: понижением температуры до состояния в точке b или испаряя при постоянной температуре воду до концентрации в точке с. Точки Ьис находятся на кривой растворимости 1-1.
При дальнейшем изменении концентрации выше точки с или понижении температуры ниже точки b образуется пересыщенный раствор, и теоретически в нем должна начаться кристаллизация. В действительности же в растворах этот процесс при небольших пересыщениях самопроизвольно не протекает. Однако, если в такой раствор внести кристаллы, то они будут расти. Область пересыщений, в которой не происходит самопроизвольно (спонтанно) процесс кристаллизации, принято называть метастабилыюй областью.
Продолжая повышать концентрацию до точки сх или понижать температуру до точки bv мы достигнем максимального или предельного пересыщения, при котором самопроизвольно начинается процесс кристаллизации.
|
|
Совокупность концентраций раствора, полученных при различных температурах, при достижении которых сразу же начинается спонтанная кристаллизация, является границей метастабильности (кривая 2-2). Она как бы делит области пересыщенных растворов на две части. Растворы концентрацией вещества выше предельной кристаллизуются моментально. Эту область пересыщений называют лабильной.
|
а |
|
1,4 |
|
60 |
|
80 |
|
1,2 |
|
100 t,°C |
|
40 |
Процесс кристаллизации. Образование центров кристаллизации
В производстве сахарных кондитерских изделий кристаллизация сахарозы наиболее выражена при получении помадных масс. Кроме того, этот процесс продолжается при формовании помадных конфет. За счет роста кристаллов в них формируется определенная структура.
Процесс кристаллизации является основополагающим при формовании молочных и ликерных корпусов конфет, а также в образовании структуры тиражированного ириса. Кроме того, этот процесс наблюдается при хранении карамели, ириса, пастилы и зефира.
Кристаллизация сахарозы, как и любого другого вещества, возможна только из пересыщенного раствора или переохлажденного расплава.
Процесс кристаллизации протекает в две стадии: вначале в пересыщенном растворе (расплаве) образуются центры кристаллизации, которые затем вырастают до видимых кристаллов.
Движущей силой любого процесса (растворения, кристаллизации) является величина отклонения системы от состояния равновесия, а направление процесса определяется изменением избыточной свободной энергии Е, которой обладает раствор или его отдельные компоненты. Свободную энергию, отнесенную к 1 молю химически индивидуального вещества, вводимого в систему или выводимого из нее, называют химическим потенциалом ц. Если раствор содержит пс молей сахарозы и пв молей воды, то при постоянных давлении Р и температуре Т
|
(IV-6) (IV-7) |
Мх; — (^Е/<Эпс)р, т,пв
цв = (ЭЕ/Эпв)р т Пс
Тогда для раствора сахарозы
|
(IV-8) |
Е = и п + и п,
“с С fB В 9
а для одного моля раствора
|
|
|
|
(IV-9)
|
Рис. 1V-2. Изменение границы метастабильной области в зависимости от температуры: 1 - чистого раствора сахарозы; 2 - при добавлении 5% патоки; 3 - при добавлении 10% патоки |
где хс и хв - мольные доли сахара и воды.
Движущей силой процесса кристаллизации является разность химических потенциалов молекул сахарозы в пересыщенном цс" и насыщенном цс" растворах:
Ац=цсп-цс". (IV-10)
Химический потенциал сахара в растворе зависит от концентрации. Для насыщенного раствора
Мс" = Mi" + RT 1пСп, (IV-11)
где цс° - стандартный химический потенциал при концентрации вещества в растворе, равной 1 молю/л.
Для пересыщенного раствора
(хсп = M. c° + R. TlnC, (IV-12)
а движущей силой процесса кристаллизации будет
^с"" Мс" = RT 1п(С/Ся). (IV-13)
Согласно общим принципам статистической механики даже в термодинамически устойчивой системе тепловое движение частиц раствора приводит к постоянному возникновению и исчезновению отклонений от их среднего распределения в единице объема. Эти отклонения называются флуктуациями. В растворах различают флуктуации плотности, ориентации молекул и концентрации. Размер, т. е. число молекул, принимающих участие в флуктуации, и степени отклонения от среднего распределения могут быть самыми различными.
Флуктуации концентрации способствуют образованию ассоциатов, состоящих из п=2 до п=пк-1 молекул растворенного вещества. Подобные образования называются зародышами новой фазы. Они могут возникать в насыщенных и даже ненасыщенных растворах, однако достигают незначительных размеров и быстро растворяются.
Возможность образования ассоциатов зависит от концентрации, температуры и природы растворенных веществ. С ростом концентрации и температуры ассоциация усиливается, так как эти факторы способствуют дегидратации молекул растворенного вещества.
В пересыщенных растворах отдельные зародыши новой фазы за счет присоединения к ним одиночных или групп молекул могут достигать такназываемых критических размеров, состоящих из пк молекул, становятся устойчивыми и способными к самостоятельному росту. Такие образования называются центрами новой фазы, или центрами кристаллизации.
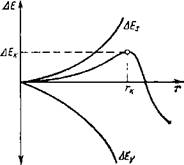
При образовании зародышей избыточная свободная энергия системы затрачивается на создание новой фазы AEv и поверхности раздела фаз ДЕ^ по уравнению
ДЕ= - ДЕу + ДЕ,. = -(ц, - ц,) n +aF, (IV-14)
где рц и ц - химические потенциалы исходной и образующей фазы; о - поверхностное натяжение на границе зародыш-раствор; F = 4лг2 - поверхность зародыша новой фазы радиусом г.
|
Рнс. IV-3. Изменение свободной энергии системы при образовании |
Как видно из рис. IV-3, функция ДЕ = f(r) проходит через максимум, который отвечает определенному радиусу г частицы. Зародыши новой фазы размерами г < г. могут расти и растворяться, а частицы размерами г > гк будут только расти, т. е. становятся центрами кристаллизации. Зародышам радиусом гк соответствует изменение избыточной энергии системы ДЕк, эквивалентное работе ДФк изотермического образования центра новой фазы, которая по Гиббсу выражается уравнением
зародышей новой фазы
ДФк = 1 / 3 о F. (IV-15)
Находясь в равновесии с жидкой фазой, кристаллический зародыш при данном его объеме V2 должен обладать минимальной свободной поверхностной энергией. Это условие определяет кристаллическую форму зародыша. Если допустить, что форма зародыша сферическая, для п получим выражение
n = 4jtr3/3V2. (IV-16)
Подставляя значения п и F в уравнение (IV-14), получим
ДЕ = 4 л г3 / 3V2 (р., - ц2) + 4лг2 о. (IV-17)
Приравнивая производную от ДЕ по г к нулю и определяя гк для центра кристаллизации в пересыщенном растворе, получим
где V, = M / p; M - масса, p - плотность кристаллического зародыша. Подставляя значение г. из формулы (IV-18) в уравнение (IV-15), получим для образования центра новой фазы выражение
ДФК = 16яо3М2 /3p2R2T2 ln(C/.CH)2 (IV-19)
Из уравнений (IV-18) и (IV-19) видно, что с увеличением пересыщения и температуры раствора гк и ДФк уменьшаются, что облегчает образование центров кристаллизации. Чем выше коэффициент пересыщения, тем меньшие по величине зародыши становятся центрами новой фазы.
Согласно теории флуктуаций, развитой Эйнштейном, вероятность образования зародышей новой фазы W зависит от величины работы по уравнению
W = |/ ехр(-ДФ / RT), (IV-20)
где |/ - предэкспоненциальный множитель.
Если допустить, что скорость образования центров кристаллизации пропорциональна вероятности их возникновения, то
I = лг ехр(-ДФк / RT). (IV-21)
После подстановки значения ДФк из уравнения (IV-19) получим
I = Ч» ехр(-16тш3М2 /3p2R3T3 1п(С /,СН )2 (IV-22)
Пересьпценные растворы обладают определенной вязкостью, что замедляет обмен молекулами растворенного вещества на поверхности зародышей и, следовательно, уменьшает скорость образования центров кристаллизации. По Я. И. Френкелю, вероятность перехода молекул в кристаллический зародыш пропорциональна выражению exp(-AU/RT), в котором AU - некоторая энергия активации, являющаяся функцией вязкости раствора по уравнению
тр А ели, кт. (IV-23)
Тогда коэффициенту в уравнении (IV-20)
\г = у, exp(-AU/RT), а уравнение для скорости образования центров кристаллизации примет
Образование зародышей новой фазы протекает по времени и является нестационарным процессом. Под действием тепловых флуктуаций в каждый момент времени распределение зародышей изменяется по размерам. Поэтому не все зародыши, достигшие величины пк-1, станут центрами кри - сталлизации. Часть из них, потеряв по одной или две молекулы, перейдут в более низкий класс пк-2, пк-3 и т. д. Поэтому фактическая скорость образования центров новой фазы будет меньше, чем вычисленная по уравнению (IV-24). Для учета нестационарного режима возникновения центров новой фазы коэффициент \г, в уравнении (IV-24), по Я. Б. Зельдовичу, примет вид
V, = |Д, ехр(-тр/т), (IV-25)
где тр - время релаксации, т. е. время, в течение которого скорость процесса уменьшается в е раз.
Тогда, обозначая
В = 16nM2/3p2R3,
окончательно для скорости образования центров кристаллизации запишем
I = Ч'2е“ли/кт • e~VT • е-Вп',/т',|п(с/сн)2 _ (IV-26)
Образовавшиеся центры кристаллизации продолжают расти за счет присоединения к решетке новых молекул. Этот процесс протекает самопроизвольно, так как сопровождается уменьшением избыточной свободной энергии системы (см. рис. IV-3). Скорость присоединения молекул пропорциональна энергии их осаждения. Присоединение в первую очередь произойдет там, где при осаждении молекулы выделится максимум энергии. Поэтому при росте кристалла прежде всего должно быть закончено построение уже имеющегося нарастающего слоя до ребра, ограничивающего данную грань. Затем возникает и до конца достраивается ближайший параллельный монослой. Скорость роста кристаллов выражается скоростью линейного перемещения грани в направлении, перпендикулярном поверхности растущей грани, или приростом массы кристаллов на единицу поверхности за единицу времени.
|
|
|
|
Рис. IV-4. Схема кристалла сахарозы Рис. IV-5. Зависимость скорости роста в пересыщенном растворе при его росте кристалла от частоты перемешивания его
в пересыщенном растворе
Сложная зависимость скорости роста кристаллов от различных факторов привела к разработке большого числа теорий роста: диффузионной, физико-химической, кинетической и флуктуационной. Рассмотрим наиболее простую, диффузионную теорию, разработанную А. Нойесом, Ф. Уитни и И. И. Андреевым.
Согласно этой теории растущий кристалл окружен неподвижным слоем прилипшего к нему раствора толщиной h (рис. IV-4). Непосредственно у самой грани кристалла концентрация раствора равна концентрации насыщения С. На расстоянии h от граней кристалла раствор пересыщен, его концентрация С. Вследствие разности концентраций (С-Сн) молекулы сахара диффундируют через неподвижный слой раствора h и, достигнув граней кристалла, выкристаллизовываются на них.
Таким образом, у граней кристалла концентрация раствора не изменяется и остается равной Сп. Следовательно, скорость кристаллизации определяется скоростью диффузии молекул сахара и подчиняется уравнению Фика, решение которого в данном случае имеет вид
G = D (С-Сн) F т / h, (IV-27)
где G - количество продиффундировавшего сахара; D - коэффициент диффузии.
Скоростью кристаллизации v называется количество вещества, которое выкристаллизовывалось на 1 м2 поверхности F кристаллов за 1 мин. Подставляя значения F и т в уравнение (IV-27), получим
v = D (С-С,) / h. (IV-28)
Коэффициент диффузии, по Эйнштейну, зависит от термодинамической температуры Т и вязкости среды Г):
где к,- постоянная величина.
Подставляя значение D из уравнения (IV-29) в формулу (IV-28), получим
|
(IV-30) |
v = к, Т (С-Си)/ hr).
Уравнение (IV-30) дает возможность установить влияние ряда факторов на скорость роста кристаллов.
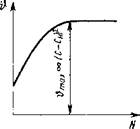
Однако диффузионная теория не смогла полностью объяснить сложного процесса роста кристаллов. Было установлено, что при интенсивном перемешивании растущих кристаллов в пересыщенном растворе скорость кристаллизации резко увеличивается, достигает некоторого максимального значения и при дальнейшем повышении частоты перемешивания остается постоянной. Величина максимальной скорости кристаллизации при зтих условиях пропорциональна не (С-См), а (С-Си)2 (рис. IV-5). Очевидно, при энергичном перемешивании неподвижная пленка раствора вокруг кристалла утончается (h ~ 0), и явлением диффузии здесь можно пренебречь.
Видимо, процесс кристаллизации в действительности протекает в две стадии: первая - диффузия молекул сахара из окружающей среды к граням кристалла через неподвижный слой раствора толщиной h; вторая - переход молекул сахара, достигших граней кристалла, из растворенного в кристаллическое состояние.
Чтобы вызвать переход вещества из одного агрегатного состояния в другое, требуется некоторая движущая сила. Такой движущей силой может быть разность концентраций. Поэтому необходимо допустить, что у самих граней кристалла раствор должен быть несколько пересыщен и иметь концентрацию С {. Тогда скорость перехода молекул сахара будет пропорциональна (Cj-CJ2.
Следовательно, скорость первой стадии кристаллизации (диффузия молекул через неподвижный слой раствора) может быть выражена уже известным уравнением
|
(IV-31) |
v, = D(C-C,)/h,
а скорость перехода вещества из жидкого состояния в твердое
|
|
где а - постоянный коэффициент.
Для установившегося процесса роста кристаллов эти скорости должны быть равны, т. е. v: = v2 = v. Если из двух последних уравнений исключить неизвестную нам концентрацию С,, а (С-С ) обозначить через ДС, то получим
v = D/h[AC + D/2a - -/D/ah(AC + D/4ah)]. (IV-33)
В сильно вязких растворах коэффициент D - очень малая величина, поэтому D/a—>0. Подставляя D/a=0 в уравнение (IV-33), получим
v = D ДС / h
шш
v = D(C-C)/h.
' v
Кинетика процесса кристаллизации
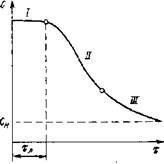
При получении помадных масс в пересыщенном сахаро-паточном сиропе протекает во времени суммарный процесс кристаллизации - образование центров новой фазы и их рост до видимых кристаллов. Поэтому концентрация сахарозы С в сиропе постепенно уменьшается и к концу процесса приближается к равновесной при данной температуре концентрации Сп. Кинетика такого процесса выражается S-образной кривой, типичной для других автокаталитических процессов.
|
Рнс. IV-6. Изменение концентрации раствора во времени |
Кривая С(т) имеет три участка (рис. IV-6), на которых характер зависимости С от т резко отличен. Первый участок представляет собой линию, параллельную оси абсцисс. Некоторое время концентрация пересыщенного раствора (при а<1,3) не изменяется. Следовательно, кристаллизация начинается не моментально, а только по истечении некоторого времени, которое принято называть индукционным или латентным периодом.
Второй участок кривой С(х) характеризуется резким падением концентрации раствора, а третий - асимптотически приближается к равновесной концентрации Сн.
Многочисленные результаты опытов показали, что с изменением концентрации раствора изменяется и величина латентного периода кристаллизации. Из уравнения (IV-26) следует, что с увеличением пересыщения раствора скорость образования центров новой фазы резко возрастает. Поэтому латентный период можно рассматривать как промежуток времени, в течение которого образуются и достигают критического размера кристаллические зародыши.
Резкий спад концентрации раствора во времени на втором участке кинетической кривой С(х) происходит в результате интенсивного роста образовавшихся центров кристаллизации при одновременном возникновении новых. Этот участок кривой удовлетворительно описывается уравнением первого порядка
Ст = С0[1-е_к(т“тл)], (IV-34)
где Ст - текущая концентрация; Со - начальная концентрация; к - константа скорости процесса; т - продолжительность латентного периода.
Определяя по кинетическим кривым С(т) значение констант скорости процесса при различных условиях кристаллизации, можно изучить влияние ряда факторов на этот процесс.
Величина латентного периода, зависящая от таких факторов, как пересыщение, температура, вязкость раствора, частота перемешивания и других, определяет кинетические параметры всего процесса кристаллизации.
Чем меньше продолжительность латентного периода, тем больше скорость образования центров кристаллизации, тем меньше угол наклона ниспадающей части кривой С(т) и тем быстрее заканчивается процесс кристаллизации.
Кинетику суммарного процесса кристаллизации в растворах можно описать уравнением Геллера-Закса:
т
G(t) = J 1(©)т(т - ©)d©, (IV-35)
О
где G(t) - масса кристаллов, образовавшихся ко времени т; 1(©) - скорость образования центров кристаллизации как функция времени ©; ш(т-©) - масса одиночного зародыша после достижения им критического размера; © - время достижения зародышем критического размера.
Зная коэффициент пересыщения а0, а также зависимость а(т) по кинетическим кривым, можно вычислить массу кристаллов G(t):
G(t) / Gc-[а0-а(х)]/0,-1, (IV-36)
где Goq - масса кристаллов в конце процесса.
Факторы, влияющие на кинетику кристаллизации сахарозы
На кинетику кристаллизации сахарозы оказывают влияние начальная концентрация, температура, частота перемешивания, вязкость раствора и др.
С увеличением начальной концентрации С0, при постоянной температуре, растет пересыщение раствора. Из уравнения (IV-18) следует, что с увеличением пересыщения критический размер зародыша уменьшается. Поэтому в концентрированных растворах центры кристаллизации образуются более легко и в большем количестве, резко увеличивая суммарную поверхность кристаллов, на которых откладываются молекулы растворенной сахарозы.
Влияние начальной концентрации на кинетику кристаллизации показано на рис. IV-7. С повышением С0 величина латентного периода резко сокращается, происходит более быстрый спад концентрации, в результате чего процесс кристаллизации заканчивается за меньший отрезок времени.
Движущей силой процесса кристаллизации является избыточное пересыщение (С0-Си), поэтому скорость кристаллизации будет увеличиваться пропорционально (С0- Сн). Этот фактор необходимо использовать при получении помадных масс и регулировании их качества.
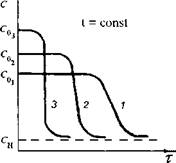
Значительное влияние на кинетику кристаллизации сахарозы оказывает температура. Если сахаро-паточный сироп уварен до постоянной концентрации С0, а охлаждается в помадосбивальной машине при разных температурах, то кинетика кристаллизации будет выражаться следующими зависимостями С0(т) (рис. IV-8).
С повышением температуры раствора число активных молекул возрастает в геометрической прогрессии, уменьшается работа образования центров новой фазы, снижается вязкость. Следовательно, скорость возникновения центров кристаллизации и их последующий рост должны возрастать. Как видно на рис. IV-8, с повышением температуры раствора продолжительность латентного периода сокращается, уменьшается наклон кинетических кривых С0(т), а процесс кристаллизации заканчивается при значительно больших равновесных концентрациях Си.
|
Рис. 1V-7. Изменение концентрации растворов во времени при постоянной температуре |
Следовательно, чем выше температура помадного сиропа в машине при начальной концентрации С0, тем быстрее образуются центры кристал-
|
|
|
72 I I і I » ' 9 10 20 ЗО 40т, мин Рис. IV-9. Изменение концентрации раствора сахарозы во времени при 50”С и частоте перемешивания (в об/мии) : I - 200; 2 - 400; 3 - 600; 4 - 800; 5 - 1000 |
|
Т |
|
Рис. IV-8. Изменение концентрации раствора во времени при разных температурах |
лизации, больше скорость их роста. Увеличивается концентрация сахарозы в жидкой фазе и уменьшается содержание твердой фазы помады.
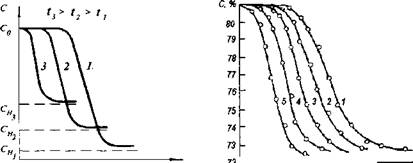
В технологии кондитерского производства перемешивание среды часто используют для интенсификации технологических процессов. С увеличением частоты перемешивания N сахарных сиропов происходит сдвиг кинетической кривой С(т) в сторону сокращения латентного периода (рис. IV-9). Процесс кристаллизации заканчивается за меньший промежуток времени. Следовательно, перемешивание надо рассматривать как фактор, ускоряющий образование центров кристаллизации.
Этот вывод имеет практическое значение для получения помадных масс, так как их структура и качество во многом зависят от количества и размеров кристаллов сахарозы.
Значительное влияние на кинетику кристаллизации сахарозы оказывает вязкость растворов. Она зависит от степени пересыщения, температуры раствора, концентрации несахаров и их состава. Основными добавками в растворах сахарозы являются крахмальная патока и как ее заменитель - инвертный сироп. Помимо влияния на растворимость сахарозы составные части патоки и инвертного сиропа по-разному влияют на вязкость ее растворов, а следовательно, и на кристаллизацию сахарозы из этих растворов.
Влияние вязкости растворов на скорость образования центров новой фазы учитывается экспоненциальным членом exp(-AU/RT) в уравнении (IV - 26), а скорость роста кристаллов обратно пропорциональна вязкости [уравнение (IV-30)].
Зависимость энергии активации AU от вязкости растворов показана в табл. IV-1.
|
Таблица IV-1. Значение вязкости и энергии активации для сахароглюкозных растворов при температуре 40...60°С
|
Из табл. IV-1 видно, что при добавлении в раствор сахарозы небольших количеств глюкозы повышается вязкость раствора и энергия активизации вязкости. Энергию активизации необходимо связать с величиной и характером межмолекулярных сил. Величина Ли зависит от концентрации и температуры раствора. Для растворов с разными С и Т энергию активизации вязкости можно определить по уравнению
|
(IV-37) |
|
0 10 го 10 W 5В S0 70 SO gOZjMUH Рис. IV-10. Изменение коэффициента пересыщения во-времени при кристаллизации сахарозы при 50°С из растворов с добавлением (в г/100 г сахарозы): 1 - чистой сахарозы; 2 - 5 г глюкозы; 3 - 5 г мальтозы; 4 - 10 г глюкозы; 5 - 10 г мальтозы |
В присутствии глюкозы, мальтозы, крахмальной патоки, инвертного сиропа кинетика кристаллизации сахарозы значительно отличается от кинетики процесса в чистых растворах (рис. IV - 10). Латентный период кристаллизации увеличивается, уменьшается наклон кривых С/Сн от х.
При добавлении в раствор сахарозы крахмальной патоки уменьшается скорость образования и рост кристаллов. Компоненты патоки, видимо, снижают скорость обмена молекул сахарозы на границе зародыш-раствор за счет повышения энергии активизации вязкости. Возможна адсорбция молекул глюкозы или мальтозы на пиранозной части молекул сахарозы, что тормозит скорость их обмена с молекулами сахарозы, вошедшими в кристаллическую решетку зародыша, также повышается время релаксации процесса и снижается скорость образования центров кристаллизации.