КРИСТАЛЛЫ
|
К |
Ристаллическим веществам свойственно вполне определённое расположение атомов и молекул, которое называют кристаллической решёткой.
|
9 Ионы хлора О Ионы натрия Рис. 1. Расположение ионов в кристалле поваренной соли. |
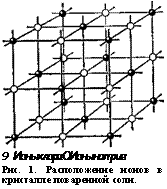 Взгляните на рис. 1. На нём изображена кристаллическая решётка поваренной соли.
Взгляните на рис. 1. На нём изображена кристаллическая решётка поваренной соли.
Ионы натрия и хлора, из которых состоит поваренная соль, размещены как бы по углам кубов, соприкасающихся своими гранями. Восемь таких кубиков образуют элементарную ячейку поваренной соли. Множество элементарных ячеек в совокупности и даёт кристаллическую решётку.
Один и тот же химический элемент может образовать разные вещества с различными формами кристаллических решёток. Такие вещества, имея одинаковый химический состав, нередко обладают совершенно противоположными свойствами. Так, например, алмаз и графит состоят из атомов углерода, но характер расположения атомов в этих веществах различен. Поэтому они по своим физическим свойствам совсем непохожи друг на друга. Графит мягок, имеет чёрную матовую окраску. Алмаз же прозрачен и так твёрд, что им режут стекло.
Кристаллические тела бывают двух видов. Одни из них, имеющие от природы форму многогранников — кубов, пирамид и т. п.,— получили название монокристаллов (или просто кристаллов). Другие кристаллические тела не имеют многогранной формы, но если рассматривать их под микроскопом, то можно заметить, что они состоят из множества мелких, сросшихся между собой монокристалликов. Та[10] кие тела называют поли - кристаллическими.
|
Рис. 2. Такой величины достигают кристаллы кварца. |
![]()
 Большинство горных пород, а также все металлы, относятся к поликри - сталлическим телам.
Большинство горных пород, а также все металлы, относятся к поликри - сталлическим телам.
Размеры монокристаллов бывают различными. У поваренной соли и сахарного песка кристаллы не больше булавочной головки, кристаллы кварца по величине иногда достигают человеческого роста (рис. 2).
В природе очень много различных кристаллических веществ. Драгоценный изумруд и обыкновенная слюда, огромные глыбы льда и крошечные снежинки — все они относятся к миру кристаллов. Лишь очень немногие твёрдые тела имеют аморфную структуру, но и они с течением времени обычно начинают кристаллизоваться. Так, можно наблюдать помутнение стекла. Это происходит в результате образования в стекле кристалликов.
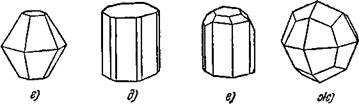
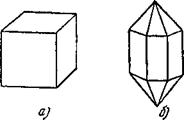
Если сравнить между собой кристаллы разных веществ, то легко заметить, что их форма различна. Например, кристалл поваренной соли имеет форму куба (рис. 3, а). Кварц кристаллизуется в виде заострённых на концах шестигранных призм (рис. 3, б). Для сравнения на рис. 3 показаны также кристаллы различных минералов*).
Внешняя форма кристалла зависит от его внутреннего строения — от формы кристаллической решётки и свойств среды, в которой он образуется.
Форма природных кристаллов часто бывает неправильной. Это объясняется тем, что кристаллы развиваются обычно неравномерно, и одни грани вырастают быстрее,
 Ф
Ф
|
Рис. 3. Различные формы кристаллов: а) поваренная соль, б) горный хрусталь (кварц), в) магнетит, г) корунд, д) берилл, е) топаз, ж) лейцит. |
А другие медленнее. Однако всем кристаллам одного какого-либо вещества присуще общее свойство: независимо от формы углы между одними и теми же гранями в таких кристаллах строго постоянны. Это свойство кристаллов получило название закона постоянства углов. Закон постоянства углов — один из важнейших законов науки о кристаллах — кристаллографии, основоположником которой является русский учёный Е. С. Фёдоров.
Как же возникают и развиваются кристаллы? Рассмотрим образование кристаллической решётки поваренной соли. Из рис. 1 видно, что ионы натрия и хлора в кристаллической решётке расположены по углам кубов не произвольно, а чередуясь через один, в строгом шахматном порядке. Такая закономерность расположения ионов не случайна. В природных условиях поваренная
соль кристаллизуется из так называемого маточного рассола соляных озёр. В водном растворе частицы натрия и хлора существуют как в виде разрозненных ионов, так и в составе молекул поваренной соли. Каждая такая молекула состоит из положительного иона натрия и отрицательного иона хлора. Возможны три случая взаимного расположения двух молекул поваренной соли (рис. 4).
Известно, что под воздействием электрических сил разноимённо заряженные тела притягиваются друг к другу, а одноимённо заряженные — взаимно отталкиваются. Поэтому в одном случае (рис. 4, а) молекулы отталкиваются,
|
N0 |
![]() И №
И №
|
N0 ©— |
![]()
|
© |
![]()
|
С1 -О |
![]() Ыа —-©
Ыа —-©
№
<+>-
|
0—*■ -*—© С1 № В) |
|
6— С1 |
|
—О Сі |
|
А] |
|
|
|
|
Рис. 4. Возможные взаимные положения двух молекул поваренной соли.
В другом (рис. 4, б) — притягиваются и в третьем (рис. 4, в) —стремятся повернуться так, чтобы занять устойчивое положение (рис. 4, б).
Вот почему молекулы поваренной соли, а также и разрозненные ионы хлора и натрия при кристаллизации группируются между собой, располагаясь таким образом, чтобы расстояния между одноимёнными ионами были как можно большими, а между разноимёнными — как можно меньшими, то-есть в шахматном порядке.
Так возникает зародыш кристалла. Постепенно его кристаллическая решётка, образованная чередующимися ионами натрия и хлора, пополняется всё новыми и новыми частицами вещества. Кристалл растёт.
Чтобы представить себе, как происходит рост кристалла, вспомните пчелиные соты. Сооружая их, пчёлы отстраивают ячейку за ячейкой, слой за слоем, как это показано на рис. 5. Приблизительно так же растёт и кристалл. Новые слои вещества откладываются на гранях зародыша так, что грани передвигаются параллельно самим себе (рис. 6). Если зародыш имел форму куба, то такую
же форму будет иметь и выросший кристалл, при условии, что грани развивались равномерно.
|
Рис. 5. Пчелиные соты. |
 Кристаллы могут образовываться из жидкого, твёрдого и газообразного состояния вещества. Так, снежинки — это кристаллики льда, образовавшиеся из парообразного состояния воды. Кристаллизация стекла — пример образования кристаллов из твёрдого состояния.
Кристаллы могут образовываться из жидкого, твёрдого и газообразного состояния вещества. Так, снежинки — это кристаллики льда, образовавшиеся из парообразного состояния воды. Кристаллизация стекла — пример образования кристаллов из твёрдого состояния.
Но проще всего получить кристалл из раствора.
Рис. 6. Так передвигаются грани кристалла при его росте.
Растворяя в стакане воды какое-либо растворимое вещество, например ту же поваренную соль, легко заметить, что сначала соль растворяется легко и быстро, затем всё медленнее и, наконец, перестаёт растворяться. Следовательно, в любом ограниченном объёме воды — в стакане, ведре, бочке и т. д.— можно растворить лишь вттолне определённое количество соли. Чем больше объём воды, тем большее количество соли удаётся растворить в ней. Вся же остальная соль, сколько бы её ни подсыпали в раствор, не растворившись, выпадет на дно сосуда в виде осадка. Раствор, содержащий наибольшее возможное количество растворимого вещества, называется насыщенным. Растворимость соли зависит от температуры. В горячей воде можно растворить гораздо больше вещества, чем в холодной.
Проделайте такой опыт. Растворите 200 граммов белых (алюминиевых) квасцов в таком количестве горячей воды, чтобы на дне сосуда оставалось немного осадка. Затем остудите раствор до комнатной температуры. Поскольку растворимость квасцов при понижении темпе
ратуры уменьшается, количество осадка увеличится. Вылейте полученный насыщенный раствор в какой-либо сосуд с широким дном и низкими стенками, например, в тарелку. Такая форма сосуда необходима для того, чтобы раствор мог свободно испаряться. При испарении количество воды в сосуде будет постепенно уменьшаться, поэтому уже на следующий день на дне тарелки можно обнаружить осадок, состоящий из мелких кристалликов. Выберите из их числа несколько самых крупных, затем слейте раствор в стакан, тщательно промойте тарелку, наполните её тем же раствором и положите на дно отобранные кристаллики.
С течением времени кристаллы квасцов достигнут больших размеров; следует лишь ежедневно промывать тарелку и через каждые пять-шесть дней изготавливать свежий раствор.
Такой же опыт можно проделать с хромовыми квасцами, медным купоросом и другими солями.
Попробуйте нарушить форму выращенных кристаллов, например, обломайте их уголки, и положите обломок кристалла в раствор. Пройдёт некоторое время, и повреждённые места затянутся сами собой,— кристалл примет первоначальную форму. Такое свойство кристаллов называется регенерацией, или самовосстановлением.
Однако, как уже было упомянуто, кристаллы, растущие в природных условиях, часто имеют неправильную форму. Иногда кристаллы двух или нескольких веществ срастаются между собой. В толще природного кристалла можно видеть трещины, загрязнения и воздушные пузырьки. Все эти дефекты объясняются тем, что в природе никогда не бывает благоприятных условий, которые требуются для правильного развития кристаллов.
Если рассматривать через увеличительное стекло кусок какой-нибудь глубинной горной породы, например гранита, который состоит из полевого шпата, кварца и слюды, то можно увидеть, что зёрнышки этих веществ представляют собой мельчайшие кристаллики, сросшиеся в одно целое. Почти все они имеют неправильную форму с криволинейными очертаниями. Это объясняется тем, что такие кристаллики развивались одновременно в ограниченном объёме и не позволили друг другу занять то место в пространстве, которое они могли занять, если бы росли на свободе.