Свойства серной кислоты и олеума
Общие сведения. Химический состав серной кислоты выражается формулой H2SO4. Валентно-структурная
Н - О О
Формула ее S Относительная молскуляр-
/ X Н-О О
Пая масса серной кислоты 98,08. Молекула безводной серной кислоты (моногидрат) представляет собой соединение одной молекулы серного ангидрида с одной молекулой воды. Если в смеси на 1 моль SO3 приходится
больше 1 моля йоды, то такая смесь иазыьается водным раствором серной кислоты. Если па 1 моль воды приходится болыче чем 1 моль БОз, то такая смесь называется олеумом. Она содержит свободный серный ангидрид. Водные растворы серной кислоты характеризуют процентным содержанием H2S04 или SO3, а олеум — процентным содержанием свободного S03 (сверх 100% H2SO4) или общим процентным содержанием SO3.
Безр ОД Но 51 серная кислота содержит 100% H2SO4 или 81,63% S03 и 18,37% Н2О. Это бесцветная маслянистая жидкость, не имеющая запаха, с температурой кристаллизации 10,37° С. Температура кипения безводной серной кислоты при давлении 1,01 -105 Па (760 мм рт. ст.) соответствует 296,2° С. Плотность пои 20° С составляет 1,8305 г/см3.
С водой и серным ангидридом серная кислота смешивается з любых пропорциях, образуя соединения определенного состава. Так, состав серной кислоты, содержащей 84,5% II2SO4 (или 69,0% SO3), выражается формулой I IzS04-Ho0, температура ее кристаллизации 8,48° С, температура кипения при 1,01-105 Па (760 мм рт. ст.) 234,2° С. При содержании в кислоте 44,95%) свободного S03 составу ее соответствует формула НгБС^-БОз, температура кристаллизации этого соединения 35,15°С, температура кипения при 1,01-105 Па (760 мм рт. ст.) 90,5° С и т. д.
Па практике часто приходится делать пересчеты содержания II2SO4 на содержание SO;,, и наоборот. Для таких пересчетов принимают следующие обозначения: А — общее содержание S03 в водном'растворе серной кислоты или в олеуме, %; Б— содержание H2SO4 в водном растворе серной кислоты или в олеуме, %; В— содержание свободного SO3 в олеуме, %.
Затем значения А, Б и В рассчитывают по формулам:
А = 0,81635, Б= 1,225 А, А ~ 81,63 + 0,1837Я, В = 5,4438 (.4 — 81,63).
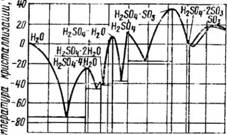
Температура кристаллизации'. На рис. 1 приведена кривая температуры кристаллизации серной кислоты. Она имеет шесть ветвей, каждая из которых обладает
1 Температуры кристаллизации серной кислоты и олеума приведены в приложениях 1 и II.
Максимумом. Это указывает на то, что в кристаллическом состоянии существует шесть соединений серного ангидрида с водой, имеющих вполне определенный состав (табл. 1).
|
О го чо во so wo го чо бо so wo Концентрация h? s0,, 7° Концентрації Ш\% |
Рис. 1. Температура кристаллизации серной кислоты
|
Таблица 1. Температура кристаллизации растворов серной кислоты и олеума различного состава
|
Минимальную температуру кристаллизации имеют соединения серной кислоты с водой и олеумом следующего состава:
Температура кристаллизации, С
|
% h„so4 38,0 68,5 75,0 93,3 |
—72,2 —44,6 —35,0 —29,5
S03 (сноб.)
18,1 61,8 64,35
Температура кристаллизации, • с
-2,8 + 1,0 —1.1
Д. гія устранения возможности кристаллизации серной Кислоты при ее перевозке и хранении установлены нормы концентрации товарной серной кислоты, соответствующие минимальным температурам кристаллизации. Значения таких концентраций кислоты приведены ниже:
% SOs (своб.)
|
% h„so4 75 92,5 104.5 |
|
Температура кристаллизации /.°С —35 —25 -2,8 —0,35 |
|
|
|
Башенная кислота. . Контактная кислота. Олеум......................... Высокопроцентный оле ум................................... |
|
114.6 |
|
Концентраций I Концентрации H2S04, % 50} (сМ),% |
П в v ю w hj іии Кощенттчи HzS04 С тд кой /разе, 7с
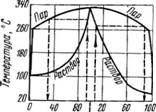
Рис. 2. Температура кипения Рис. о. Состав пара над
Серной кислоты при давле - серной кислотой при
Нип 1,01 -105 Па (760 мм температуре кипения
Рт. ст.)
Температура кипения [1] и давление паров. На рис. 2 показана кривая зависимости температуры кипения серной кислоты от ее концентрации. С повышением концентрации водных растворов серной кислоты температура кипения повышается, достигая максимума (336,5° С) для 98,3% H2S04, а затем понижается.
Температура кипения олеума с увеличением содержания свободного SO3 снижается от 296,2° С при 0% SO3 до 44,7° С при 100% S03, т. е. до температуры кипения серного ангидрида.
Пары над растворами серной кислоты состоят из смеси Н2О, H2SO4 и S03 (общее давление паров). Состав паров отличается от состава жидкости. Над кислотой, имеющей концентрацию H2SO4 менее 98,3%, в парах со
держится больше Н20, чем H2S04, a SO3 почти отсутствует. Если концентрация H2S04 выше 98,3%. то большая часть паров над такой кислотой состоит из HoS04. Над олеумом пары состоят в основном 113 SO3.
В связи с тем что составы жидкой н газовой фаз различны, при конденсации газовой фазы получается кислота с концентрацией H2SC>4, отличающейся от концентрации H2S04 в исходной жидкой фазе. Так, при конденсации паров над кипящей кислотой с концентрацией H2S04 ниже 80% сконденсированная жидкая фаза содержит практически одну воду со следами серной кислоты. Исключением является кислота с концентрацией H2S04 98,3%. Такая кислота называется азеотропної"і смесью. Состав газовой фазы над этой кислотой одинаков с составом жидкой фазы, т. е. при конденсации пара над пей сконденсировавшаяся жидкая фаза имеет также концентрацию H2S04 98,3%.
На рис. 3 приведена зависимость состава газовой фазы над серной кислотой от концентрации H2S04 при температуре кипения.
Общее давление паров над растворами серной кислоты и олеумом вычисляется по формуле
Где р — давление паров, мм рт. ст. (1 мм рт. ст.= = 133,32 Па); А и В — коэффициенты; Т — абсолютная температура, К.
Значения коэффициентов А и В для расчета общего давления паров над водными растворами серной кислоты следующие:
|
"/«H^Oi |
А |
В |
%H„so, |
А |
О |
|
10 |
8,925 |
2259 |
65 |
8,853 |
2533 |
|
20 |
8,922 |
2268 |
70 |
9,032 |
2688 |
|
30 |
8,864 |
2271 |
75 |
9,034 |
2810 |
|
35 |
8,873 |
2286 |
80 |
9,293 |
3040 |
|
40 |
8,844 |
2299 |
85 |
9,239 |
3175 |
|
45 |
8,809 |
2322 |
90 |
9,255 |
3390 |
|
50 |
8,832 |
235^ |
95 |
9,790 |
3888 |
|
55 |
8,827 |
2400 |
98,3 |
9,780 |
4211 |
|
60 |
8,841 |
2458 |
100 |
9,805 |
3914 |
Данные разных исследователей об общем давлении паров над олеумом расходятся. По результатам наиболее поздних измерений коэффициенты А и В имеют следующие значения:
% S03 (своб.) 5 10 15 20 25 ЗО 35 65 100
4 ....................... 8,51 9,01 9,47 9,84 10,16 10,44 10,70 10,50 9,89
В........................ 2750 2812 2871 2915 2941 2965 2977 2510 2230
Если необходимо рассчитать парциальное давление H2S04 (без учета парциального давления Н20) над водными растворами серной кислоты, пользуются также уравнением (11), но коэффициенты Ли В имеют уже другое значение:
% H2S04 ................. 85 90 93 95 98
А............................ 7,751 7,897 8,170 8,316 8,470
В.............................. 3742 3685 3656 3637 3593
Такие свойства растворов серной кислоты, как температура кипения и давление паров, имеют большое значение при производстве серной кислоты. Например, при упаривании разбавленной серной кислоты необходимо учитывать температуру ее кипения и зависимость этой температуры от давления. Используя свойство понижения температуры кипения в вакууме, можно провести процесс концентрирования в менее напряженных условиях, т. е. при более низкой температуре. При расчетах баланса воды в системе, концентрации вытекающих из башен кислот, концентрации конденсатов серной кислоты в фильтрах и т. д. необходимо уметь рассчитывать давление паров воды, серной кислоты и серного ангидрида в зависимости от концентрации орошающих кислот и их температуры.
Плотность. Плотностью называется масса, отнесенная к единице объема. Если выразить массу данного вещества в граммах, а его объем в кубических сантиметрах, то размерность этой величины будет г/см3.
Плотность безводной серной кислоты при 0° С составляет 1,853 г/см3. Это значит, что 1 см3 100%-ной серной кислоты при 0°С имеет массу 1,853 г. Плотность серной кислоты и олеума определяют прибором, называемым ареометром, или путем расчета по результатам химического анализа.
Плотность серной кислоты и олеума зависит от их концентрации. Каждому значению концентрации кислоты и олеума соответствует определенная плотность. Это дает возможность в большинстве случаев, измерив плотность серной кислоты, определить ее концентрацию.
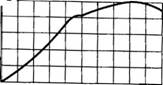
На рис. 4 показана зависимость плотности серной кислоты и олеума от их концентрации при 20° С. Ветвь кривой, соответствующая растворам серной кислоты в воде,
имеет максимум, отвечающий 98,3%-иой концентрации I I2S04. Это значит, что при повышении концентрации серной кислоты до 98,3% плотность ее возрастает. При дальнейшем повышении концентрации кислоты плотность ее несколько снижается. При концентрации H2SO4 95—100% плотность меняется незначительно, поэтому определять концентрацию кислоты по ее плотности в этом интервале не следует. В данном
|
1 го чо бо so wo Концентрация SOj (свої), % |
|
Рис. 4. Плотность серной кислоты и олеума при 20° С |
|
1,8 1,4 U 1.0, |
|
1 |
|
О го чо бо so Концентрация Нzsob % |
2,0т-
Случае более точные результаты даст химический анализ.
Ветвь кривой, соответствующая олеуму, также имеет максимум. Этот максимум отвечает 62%-ной концентрации свободного S03 в олеуме.
Плотность серной кислоты и олеума зависит также от температуры. С повышением температуры плотность уменьшается, с понижением увеличивается. В связи с этим при измерении плотности необходимо знать температуру кислоты, чтобы внести 'необходимую поправку и вычислить плотность, соответствующую нормальной температуре (20° С).
Теплота образования. Тепловые эффекты реакций получения серной кислоты и промежуточных соединений при 298 К (25° С) имеют следующие значения:
Реакция кДж/моль ккал/моль
TOC \o "1-3" \h \z S (газ)-*-Б (ромб)..................................... 64,98 15,51
S (ромб)+02 (ra3)-*-S02 (газ) . . . 297,30 70,96
502 (газ) +1/202 (ra3)-*-S03 (газ) . 96,11 22,94
503 (газ)->803 (жндк.)............................. 39,80 9,50
SOs (газ) +Н20 (ra3)^H2S04 (газ) 124,99 29,83
H2S04 (ra3)-*-H2S04 (жидк.) .... 50,20 11,98
Н20 (газ)-*-Н20 (жидк.)............................. 44,08 10,52
|
Q |
|
М +0,2013 504,2М. |
|
Ккал/кг S03, (12) |
|
М + 0,2013 |
Теплота образования серной кислоты при температуре < = 20 (в °С) вычисляется но уравнениям: 2113Af. 2,99 (/—15)
-кДж/кг S03l
' М 4-0,062 0,714(1— 15)
Q -
М +0,062
где Q — теплота образования серной кислоты; М — количество воды в серной кислоте, кг/кг S03; t — температура, °С.
Для выражения теплоты образования серной кислоты в кДж/кг H2S04 надо результат, полученный в уравнении (12), разделить на величину 1,22, выражающую отношение относительных молекулярных масс II2S04 и S03.
Для серной кислоты, содержащей С % SO3,
М= Ш~С. (13)
Теплота образования 100%-ной серной кислоты при 25° С равна 2107,9 кДж/кг S03.
Например, надо определить теплоту образования 90%-ной серной кислоты при 20° с. По уравнению (13) находим
100 — 73,47 М =- : = 0,361.
73,47
По уравнению (12)
2113-0,361 . 2,99(20— 15) „ „
Q—---------------- 1--------- А-------- —г----------- — = 1392 кДж/кг S03,
0,361 +0,2013 1 0,361 +0,062
Или 1142 ккал/кг H2S04.
Теплота разбавления и смешивания. При добавлении воды к серной кислоте выделяется тепло, называемое теплотой разбавления.
Теплота разбавления серной кислоты Qp выражается в кДж/кг 100%-ной H2SO4 и может быть вычислена несколькими способами.
Ее можно определить как разность теплот образования серной кислоты (при конечной концентрации С2 и начальной концентрации С|):
QP=Q2-QI. (14)
Значения Qt и Q2 находят по уравнению (12).
Теплоту разбавления можно определить по уравнению
QP = (0lMT2-Q.«Tl)Q, (15)
Где Q„ht2 и Q„hti — интегральные теплоты растворения для кислот прн коенчной концентрации С2 и начальной С і (в долях).
Интегральной теплотой растворения называют количество тепла, выделяющегося при растворении 1 кг
H2S04 в и кг Н20 с образованием («+1) кг раствора с концентрацией С.
Величины интегральных теплот растворения приводятся в справочной литературе. Они выражены в кДж/кг 100%-ной H2S04.
Теплоту разбавления серной кислоты можно рассчитать и как разность теплот бесконечного разбавления кислот соответствующих концентраций:
Qp=AQe. p=Qi6.p—Q26.P, (lfi)
Л
Где Qio. p и Q26.p — теплоты бесконечного разбавления кислот начальной Сі и конечной С2 концентраций.
Теплотой бесконечного разбавления (или теплотой растворения) называют количество тепла, выделяющегося при растворении 1 кг вещества в таком количестве растворителя, что при дальнейшем его прибавлении тепло уже не выделяется.
На рис. 5 показана зависимость теплоты бесконечного разбавления серной кислоты от концентрации ее при 20° С.
Теплота бесконечного раа&авдаыдя 100%-ной серной кислоты составляет 93| гЛ'ж/кг HgSO^ 12И4 ккал/кг).
При смешивании кислот различной концентрации выделяется тепло, называемое теплотой смешивания. Теплоту смешивания QCm можно рассчитать по уравнению
Qcm = Q3("i + "2)-Qi"i-Q2"2, (17)
Где Q\, Qi, Qz — теплоты разбавления 100%-ной H2S04 до концентраций исходных кислот и конечной концентрации; «і, По — массы серной кислоты, взятые для смешивания, кг 100%-ной H2SO4.
Например, надо определить количество тепла, выделяющегося при разбавлении 90%-ной серной кислоты до концентрации 50% H2S04 при 20° С.
Задачу решают, пользуясь уравнением (16) и рис. 5.
По рисунку находят теплоту бесконечного разбавлеиия 90 и 50%-ной кислот и определяют их разность.
Q90% = 730 кДж/кг H2S04; Qso%=350 кДж/кг H2S04. <?р = д<?б. р = Q90%-Qsv% =380 кДж/кг H2S04.
По уравнению (15) количество выделяющегося тепла можно найти следующим образом:
Qp = (Qhht50% ~ Оинт90%)
Где 0,9 — доля 100%-ной серной кислоты в разбавляемой кислоте.
Qp = (605,6—186,0)0,9 = 378 кДж/кг H2S04,
Сходимость удовлетворительная.
Пусть необходимо определить теплоту смешивания 1 кг 90п/о-ной и 1 кг 50%-ной кислоты при 20° С. Теплоту смешивания рассчитывают по уравнению (17):
<?см=<?з(0,9 + 0,5)-<?2-0,9-Ог0,5,
Где 0,9 и 0,5 — содержание (в долях) 100%-ной H2S04 в кислотах концентрации 90 и 50%.
Концентрацию получаемой кислоты рассчитывают так:
0,9 + 0,5 ' =0,7(70%).
Пользуясь рис. 5, находят теплоту разбавления кислот концентрации 70, 90 и 50% и определяют искомую величину:
QCK = (937,8 — 500) 1,4 — (937,8 — 740) 0,9 — — (937,8 — 340)0,5= 136 кДж.
При получении олеума любой концентрации путем смешивания серного ангидрида с водой выделяется теплота смешивания, которую определяют следующим образом:
Qc«=Qioo-Q0. (18)
Где Qioo теплота бесконечного разбавления 100%-ного серного ангидрида, кДж/моль S03 (ккал/моль SO3); Q„ — теплота бесконечного разбавления олеума данной концентрации, кДж/моль SO3 (ккал/моль S03).
Теплоту разбавления олеума можно определить, пользуясь рнс. 5. В этом случае концентрацию олеума следует виразить в % H2S04. Теплота бесконечного разбавления 100%-ного серного ангидрида (122,5% H2SO4) соответствует 1846 кДж/кг H2S04 (440,8 ккал/кг H2S04). Теплоту смешивания олеума можно найти также, пользуясь рис.4, по уравнению, аналогичному уравнению (17).
Дифференциальная теплота разбавления. Дифференциальной теплотой разбавления называется тепло, выделяющееся при добавлении к серной кислоте (олеуму) такой небольшой массы серной кислоты или воды, при которой концентрация кислоты меняется незначительно.
Эти данные используются при расчете количества тепла, выделяющегося при абсорбции серного ангидрида в олеумном и моно- гидратном абсорберах н при поглощении паров воды из газа в сушильной башне.
Теплота испарения. Теплоту испарения воды из серной кислоты данной концентрации при определенной температуре вычисляют по уравнению
Q„cn=™(Q2-Qi)+^. (19)
Где Q2, Q\ — теплоты разбавления 100%-ной серной кислоты до конечной и начальной концентраций, кДж/моль (ккал/моль); т — количество H2S04 в исходной кислоте, моль; L —- теплота испарения 1 кг воды при данной температуре, кДж (ккал); b — количество испарившейся воды, кг.
Теплота испарения безводной серной кислоты составляет 510,7 кДж/кг (122,12 ккал/кг).
Теплоту испарения серного ангидрида из олеума находят по формуле
Где Qb Q2, Q3 — теплоты бесконечного разбавления исходного и полученного олеума и 100%-ного серного ангидрида, кДж/моль SO3 (ккал/моль SO3); т — количество SO3 в исходном олеуме, моль; т,\ — количество испарившегося S03, моль; q — теплота испарения 1 моля жидкого серного ангидрида, кДж (ккал).
Прочие свойства серной кислоты и олеума. Теплоемкость серной кислоты уменьшается с повышением кон-
Центрации раствора серной кислоты и достигает минимума для безводной серной кислоты—1,42 Дж/(г-°С) [0,338 кал/(г-°С)]. Теплоемкость олеума с повышением содержания S03 (своб.) увеличивается, с повышением температуры теплоемкость водных растворов серной кислоты и олеума несколько возрастает.
Теплопроводность серной кислоты уменьшается с повышением концентрации и понижением температуры. Она может быть рассчитана по формуле
|
|
Где t — температура кислоты, °С; С — концентрация кислоты, % H2S04.
Теплопроводность здесь выражена в Вт/(м-°С).
Вязкость водных растворов серной кислоты и олеума изменяется в зависимости от содержания в них H2SO4 и S03. Как видно из рис. 6, максимальную вязкость имеет серная кислота с концентрацией 85 и 100% H2S04 и олеум, содержащий 50—55% S03 (своб.). С повышением температуры вязкость серной кислоты уменьшается.
Поверхностное натяжение серной кислоты имеет максимум примерно при 40%-ном содержании H2SO4. С повышением температуры поверхностное натяжение уменьшается.