СОСТАВ КОНТАКТНЫХ МАСС
В основном контактные массы — это сложные системы, состоящие из ряда компонентов, каждый из которых несет свою функциональную нагрузку. Однако в целом активность катализатора не есть аддитивная величина двух или нескольких соединений, а может принимать экстремальные значения, соответствующие определенным свойствам системы в целом. Причем последняя окончательно формируется под действием реакционной среды. Исследования, проведенные рядом ученых [20,42] в области катализа, показали, что под действием реакционной среды устанавливается химический состав, характеризуемый определенной активностью, которая подчас не находится в прямой зависимости от исходного состояния контактной массы.
Катализатор — это участник химического взаимодействия между реагентами. Причем процессы воздействия реакционной смеси на катализатор не обязательно являются стадиями каталитической реакции. Учитывая это обстоятельство,'необходимо изучение кинетики реакций гетерогенного катализа как в стационарном, так и при нестационарном состоянии катализатора. Катализаторы представляют собой сложные системы, которые помимо основных активных веществ могут содержать промотирующие добавки и носитель. Кроме того, под действием реакционной среды состав контактных масс, как правило, трансформируется и соответственно усложняется.
Промотором (активатором) называют добавку к катализатору небольшого количества вещества, которое может быть само по себе каталитически неактивным в отношении данной реакции, но сильно повышает активность собственно катализатора. Это своего рода катализаторы для катализаторов [42, 43]. Эффективность действия промоторов зависит от их количества (см. рис. 1.2). При определенном соотношении активного компонента и промотора наблюдается максимум активности.
По классификации, данной Ч. Сеттерфилдом [39], промоторы делят на два основных класса: текстурные, оказывающие физическое воздействие, и структурные, природа влияния которых химическая.
Текстурные промоторы присутствуют в катализаторе, как правило, в виде мелких частичек и оказывают тормозящее действие на спекание активной фазы. Эффективность промотора связана с его дисперсностью, которая должна быть значительно выше, нежели таковая активной составляющей. Текстурные промоторы должны иметь высокую температуру плавления, например: У А1203 tajl = 2027 °С, у Si02 — 1700 °С, у Сг203 — 2435 °С, y MgO—2802 °С ит. д. Текстурные промоторы не изменяют энергии активации реакции. Примером текстурного промотора может быть оксид алюминия, вводимый в малых количествах в железный катализатор синтеза аммиака [44], или же оксид хрома в цинк - хромовом катализаторе синтеза метанола. Оксид хрома уменьшает спекание оксида цинка, который в «чистом виде» является хорошим катализатором, но очень быстро теряет свою активность из-за образования больших кристаллов [19, 45—47].
Структурные (химические) промоторы изменяют химический состав катализатора. При этом механизм их действия сложен и не однозначен. Они могут следующим образом воздействовать на катализатор: а) ускорять образование промежуточных соединений; б) создавать дефекты в кристаллической решетке или промежуточные замещения; в) изменять электронную структуру катализатора, т. е. облегчать присоединение или отрыв электронов в кристалле, и, следовательно, изменять прочность хемосорб - ции.
В отличие от текстурных промоторов, структурные изменяют энергию активации реакции. Так, введение КгО в железный катализатор синтеза аммиака изменяет хемосорбционные свойства катализатора по отношению к водороду и кинетику реакции.
Смешанные катализаторы отличаются тем, что практически все компоненты в них находятся в соизмеримом количестве и являются активными в отношении данной реакции [44, 47, 48]. Составляющие смешанных контактных масс в процессе их формирования могут реагировать между собой с образованием нового, более активного соединения. Так, железомолибде - новый катализатор окисления метанола в формальдегид представляет собой молибдат железа, получающийся при соотношении оксидов молибдена и железа, равном 1,5 : 1. Катализатор, содержащий иное соотношение оксидов, будет менее активен в результате существования двух фаз — молибдата железа и избытка Мо03 или Fe203 [49]. В железомедном катализаторе окисления диоксида серы происходит образование сложных совместных же - лезомедных соединений типа CuFe02, CuFe204, Fe2Cu04, что обеспечивает повышение активности по сравнению с чистыми оксидами железа и меди [50]. Повышенная активность смешанных катализаторов может быть связана с тем, что реакция протекает на границе раздела фаз и на нее влияют поверхности различных типов.
Катализаторы на носителях являются широко распространенным типом сложных контактных масс. При подборе носителей следует иметь в виду их определенные основные характеристики: 1) необходимые механические свойства, в том числе прочность на раздавливание и истирание, твердость; 2) стабильность в условиях реакции и регенерации (в том числе термостойкость и коррозионная устойчивость); 3) пористость, определяемую средним размером пор и распределением объемов пор по радиусам [39, 51, 52].
В настоящее время все шире используют синтетические носители, которые имеют по сравнению с природными материалами ряд преимуществ. К таковым можно отнести: постоянство химического состава; возможность регулирования пористой структуры, что позволяет ее оптимизировать; возможность получения катализаторов в виде гранул заданных формы, размеров и др. [41].
Оптимальное сочетание указанных характеристик прежде всего удалось получить для оксида алюминия, силикагеля и активного угля. Именно эти материалы широко распространены как носители.
Носитель не должен спекаться в условиях реакции. Спекание обычно начинается при температуре, составляющей 0,5 от температуры плавления. Следовательно, носитель должен иметь очень высокую температуру плавления. У металлов заметная подвижность поверхностных частиц появляется при температурах, в три раза меньших температуры плавления. Поэтому такие металлы, как Си, Ag, Аи, с точкой плавления около 1300 К для поддержания большой поверхности почти всегда должны быть нанесены на носитель или же должны содержать текстурный промотор. Переходные металлы Fe, Со и Ni, плавящиеся примерно при
|
Рис. 2.3. Схематическое изображение распределения нанесенного активного компонента |
1800 К, становятся подвижными при температуре выше 520— 570 К - Металлы платиновой группы плавятся при высоких температурах, но их наносят на носитель в целях экономии [39].
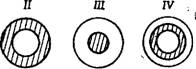
Тип и характер пористой структуры носителей • определяют распределение активного компонента по зерну. В ряде работ [20, 53, 54 ] принято деление нанесенных катализаторов на четыре основных типа: 1 — с равномерным распределением активного компонента; 2 — «корочковый», в котором активный компонент сосредоточен у периферии гранул; 3 — активный компонент сосредоточен в центре зерна (тип «яичного желтка)»; 4 — активный компонент сосредоточен в слое, удаленном от внешней поверхности. Все четыре типа изображены схематично на рис. 2.3. При отсутствии диффузионных торможений целесообразно распределение активного компонента по типу 1. Для процессов, протекающих в диффузионной области, эффективно иметь катализатор 2-го типа. Преимущества катализаторов 3- и 4-го типов прежде всего связываются не с макрокинетическими факторами, а с технологическими [55]. Но и с точки зрения макрокинетики есть указания [56] на то, что для последовательных реакций, таких, как А ->-
В ->- С, избирательность процесса по целевому продукту С увеличивается при использовании катализаторов 3- или 4-го* типов.
Локальное и макроскопическое распределение активной составляющей зависят от структурных и физико-химических характеристик носителя, количества активного компонента, механизма взаимодействия активного компонента с поверхностью носителя и условий синтеза [55]. Определенное распределение активного компонента создается при пропитке и сушке. В работах [55, 56] показано, что в зависимости от формы связи активного компонента с поверхностью носителя нанесенные контактные массы делят на две группы: сорбционные и пропиточные. В первой группе катализаторов активный компонент связывается с поверхностью носителя за счет сорбции на стадии пропитки; во второй — количество сорбированной активной составляющей очень мало по сравнению с ее общим количеством, так как в этом случае активный компонент в основном связывается с поверхностью носителя при сушке путем механического осаждения.
В пропитанном носителе соотношение между сорбированным и осажденным активным компонентом в равновесных условиях определяется изотермой сорбции, т. е. равновесной связью между поверхностной концентрацией Ст, равновесной концентрацией раствора С и макроструктурой носителя [55]. Можно записать следующее балансовое соотношение:
А = CmSyA/yyA = f (С) 5Уд/уУд = (С0 - С) vp/vynm — и0С. (2.4)
Здесь а •— равновесная концентрация сорбированного компонента в расчете на единицу объема пор; SyA — удельная внутренняя площадь поверхности; УуД — удельный объем пор; С0 — начальная концентрация раствора; ур — объем раствора; т — масса носителя; и0 — начальная насыщенность носителя чистым растворителем.
Тип катализатора определяется отношением между количеством сорбированного и растворенного активного компонента:
А /(с) зуд К (С) зуд /с л
Здесь к (С) = / (С)/С — характеристика изотермы сорбции, которая в линейной области изотермы совпадает с константой Генри.
В случае нелинейной изотермы сорбции лэнгмюровского типа параметр х сохраняет постоянное значение в области Генри, а при росте количества активной составляющей С0УР в системе и соответствующего насыщения поверхности убывает до минимального значения, отвечающего концентрации насыщенного раствора
Г
"нас = * (Снас) = CV(Cнас^уд)- (2-6)
Здесь — предельная сорбционная емкость грамма носителя.
При и > 1 компонент находится преимущественно в сорбированном виде (сорбционные катализаторы), а при и 1 — пропиточные катализаторы.
Необходимый состав контактной массы в значительной степени определяется условиями протекания каталитического процесса, составом исходной смеси (в частности, влажностью, наличием посторонний инертных или ядовитых примесей), температурой и гидродинамикой процесса [4, 12].
Активность катализаторов, т. е. собственно активных веществ, связана с положением элементов, составляющих периодическую систему. Подбор катализаторов даже для таких хорошо изученных реакций, как окисление аммиака, метанола, нафталина, диоксида серы, синтез аммиака, высших спиртов, конверсия оксида углерода, является эмпирическим, требует длительного поиска и усовершенствования [19, 20, 44].
Прямой переход от эмпирических методов подбора к точной теории предвидения каталитического действия достаточно сложен. Имеются лишь отдельные прогнозы создания катализаторов с заданными свойствами. Так, существует корреляция между положением элемента в периодической системе и каталитической активностью. Элементы, расположенные в правой верхней части таблицы, образуют оксиды, хорошо ускоряющие процессы дегидратации и крекинга.
В окислительно-восстановительных реакциях наибольшей активностью обладают металлы VIII группы, содержащие элементы с частично незаполненными d-оболочками, но наблюдаются определенные различия в зависимости от. катализируемой реакции.
Катализаторами могут быть и редкоземельные элементы с недостроенными /-оболочками. В большинстве случаев активность первоначально возрастает с увеличением числа d-электронов, проходит через максимум, положение которого определяется природой катализируемой реакции, а затем падает.
Вопрос об активности соединений, например оксидов металлов, более сложен, поскольку приходится учитывать такие факторы, как характер химической связи между элементами, структура кристаллической решетки, полупроводниковые свойства оксидов и т. д.
Для полупроводниковых контактных масс, имеющих в своем составе переходные элементы, как и для металлов, наибольшая активность достигается вблизи окончания заполнения зоны переходных элементов, после чего наступает более или менее резкое снижение. Но есть и отклонения от общей тенденции.
Что касается кислотно-основного катализа, то в периодической системе в пределах отдельных групп кислотность соединений и соответственно их каталитическая активность в отношении реакций кислотного катализа снижаются с увеличением порядкового номера основного элемента. При перемещении в больших периодах слева направо кислотность соединений и каталитическая активность в отношении указанных реакций возрастают. Противоположным образом снижается активность в отношении реакций основного катализа [57].
Необходимо учитывать, что катализатор должен обладать химическим сродством хотя бы к одному из компонентов реакции. Исключаются химически инертные вещества и те из химически активных для данной системы, которые образуют прочные соединения с реагентами. Пригодность того или иного вещества в качестве катализатора в какой-то мере оценивается определенными термодинамическими соотношениями.
В гетерогенном катализе большее признание получила теория поверхностных промежуточных соединений адсорбционного типа [20, 58]. Принимая за основу термодинамический принцип, исследователи максимально активным образцом считают тот, у которого адсорбционный потенциал (q) равен полусумме энергий реагирующих связей (5Р).
Из высказанного выше следует, что между удельной каталитической активностью и значениями q существует прямая связь [59]. Так, в процессе окисления S02 каталитически активными соединениями являются оксид ванадия (V) и платина. Однако энергия связи 5р кислорода с V205 превышает значение 5Р для платины.
При сравнении активности некоторых оксидов металлов замечено, что она возрастает с понижением энергии связи кислорода, которая зависит от легкости изменения валентного состояния катиона металла в оксиде, определяемого его электронной структурой. Отсюда вытекает возможность регулирования каталитической активности оксидных катализаторов путем введения добавок. Добавка оксидов, содержащих более электроотрицательный катион, уменьшает энергию связи кислорода и соответственно повышает каталитическую активность, причем последняя возрастает с увеличением порядкового номера промотирующего металла.
По значению 5Р оксиды можно разбить на следующие группы [581:
А б в
Sp Менее 50 50—70 Более 80
Оксиды Ag20; Со304; Мп02; Fe203; Fe304; FeO; V03; ZnO; WO; Mo03;
NiO; CuO CdO; Sn02; V205; Ti02; Sb205
Cr203
Если базироваться на термодинамическом принципе подбора активных катализаторов для окислительных процессов, то наиболее активными должны быть оксиды группы «а». В действительности наивысшей активностью обладают оксиды металлов группы «б» и особенно V205. Следовательно, значение 5Р не является единственным критерием каталитической активности.
Энергетические факторы необходимо сочетать со структурными соответствиями молекул реагентов и катализаторов [60]. Так, в элементарной ячейке V205 имеются такие расстояния между атомами кислорода, которые весьма близки к длине связи между атомами углерода в молекуле бензола и других аромати - ских веществ. Оксид ванадия — хороший катализатор для процессов окисления толуола и нафталина во фталевый ангидрид [58].
В заключение следует отметить, что проблема подбора активных и избирательных катализаторов для химических реакций до сих пор не реализована, несмотря на многочисленные попытки решить ее на основе тех или иных представлений о сущности и механизме каталитического действия.