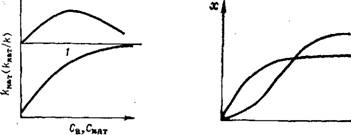АКТИВНОСТЬ КОНТАКТНЫХ МАСС
В качестве меры активности катализатора применяют различные показатели каталитического процесса.
1. Энергия активации каталитической реакции характеризует активность катализатора, но неудобна для применения вследствие ее размерности, экспоненциальной и обратной зависимости от температуры.
2. Предложено [29] применять разность скоростей химических реакций в присутствии катализатора («кат) и без него (и) с учетом доли объема реакционного пространства сркат, занимаемого катализатором и недоступного для реагирующих веществ:
А =иКат — "(1 — Фкат)- (1-16>
Такое выражение активности можно применять при постоянной движущей силе процесса АС [см. уравнения (1.3), (1.3а)].
3. Наиболее удобно характеризовать целесообразность применения катализатора для ускорения некаталитической реакции отношением констант скоростей каталитической &кат и гомогенной некаталитической k реакций:
Л=Ч - = -пГехр [Д*/(*Г)]- (1 Л7>
Для каталитических реакций, в которых предэкспоненциаль - ный множитель k0 остается таким же, как в некаталитических реакциях (&окат = К):
6„ат/£ = ехр[Д EKRT)]. (1.17а)
Уравнения (1.17) и (1.17а) можно применять для сравнения скоростей каталитического процесса с некаталитическим при постоянстве движущей силы реакции или для сравнения различных катализаторов.
В уравнениях (1.17) и (1.17а) снижение энергии активации каталитической реакции по сравнению с некаталитической равног
АЕ = Е — £кат. (1.18)
4. Для сравнения активности катализатора в какой-либо реакции при различных условиях используют в качестве меры
активности интенсивность процесса на данном катализаторе, выражаемую количеством продукта Gn, получаемого за 1 ч с единицы объема v катализатора:
4 = G„/(trr). (1.19)
|
(1.20) (1.21) |
Количество продукта можно также относить к единице массы катализатора GK3T или работающей площади поверхности S; в последнем случае получают удельную активность Луд:
Луд = Оп/(ОкатТ),
Луд = Ga/(Sr) = Gn/(Sy„vr).
Здесь Sy„ — удельная площадь поверхности, м2 на 1 м3 катализатора.
5. Средние активности различных катализаторов в данном каталитическом процессе при избранных стандартных условиях [(С, Т, Р, w, т) = const] часто проводят по степени превращения х основного исходного вещества. При любом ее выражении каталитическая активность определяется свойствами всей взаимодействующей системы, включающей катализатор и реакционную смесь.
Активность катализатора для процессов, протекающих в кинетической области, определяется прежде всего природой реагирующих веществ и специфичностью катализатора, т. е. активность катализатора в процессе соответствует его активности в химической реакции. Однако в тех случаях, когда скорости химических и диффузионных стадий каталитического процесса сопоставимы, активность катализатора по отношению к процессу уже не совпадает с активностью его в химической реакции, не осложненной диффузией. Для такого процесса константа скорости зависит от коэффициентов диффузии из ядра потока к поверхности зерна и внутри пор зерна [см. уравнение (1.4)].
В результате для химического процесса общая активность может быть функцией многих параметров технологического режима и физических свойств катализатора:
|
Здесь Скат, Са, Си, С'и, Сп, Сприм—концентрации катализатора, активатора (промотора), исходных веществ, продукта, примесей соответственно; d3 ср — средний размер (диаметр) зерна; гэ — эквивалентный радиус пор; Ми, Мп — молекулярные массы исходных веществ и продукта соответственно. Остальные обозначения приведены выше. |
В практических случаях большая часть независимых переменных, входящих в функциональную зависимость (1.22), остается неизменной или же изменяется настолько, что не влияет на активность катализатора. Однако каждая независимая переменная при значительном изменении условий может сказаться на активности катализатора.
Рис. 1.3. Изменение степени превращения •* основного исходного вещества во времени для обычной (/) и автокаталнтической (2) реакций при постоянстве температуры
Концентрация ка т^а'л и^з а т о р а Скат влияет на активность при гомогенном катализе^ в соответствии с кривой 1 (рис. 1.2). Кинетическое уравнение суммарной каталитической реакции синтеза А + В + К АВ + К имеет вид:
|
|
|
U = kC |
(1.23)
Здесь т — коэффициент, уменьшающийся от 1 до 0 с возрастанием избытка катализатора.
В контактных аппаратах гетерогенного катализа почти всегда имеется такой избыток катализатора в расчете на количество реагента А, единовременно находящегося в реакционном объеме, что можно принять m — 0. Однако концентрация каталитически активного вещества в контактной массе влияет соответственно уравнению (1.23).
Концентрация активатора Са имеет значение в гомогенном и гетерогенном катализах (рис. 1.2, кривая 2). Избыток активатора при гетерогенном катализе может вызвать экранирование собственно катализатора в зернах контактной массы.
|
Рис. 1.2. Влияние концентрации катализатора Скат (/) и активатора Са (2) на константу скорости каталитической реакции Акат или активность катализатора Акат/А |
|
Z 1 |
|
X |
Значительное изменение концентрации исходных веществ Си, Си может привести к замене одного лимитирующего этапа процесса другим. Соответственно изменится и вид кинетического уравнения. Так, в реакциях окисления органических примесей кислородом воздуха при большом избытке кислорода общая скорость процесса и не зависит от концентрации кислорода Сог, а при недостатке кислорода — пропорциональна ей. Кроме того, значительное изменение концентрации может привести к появлению нового химического соединения реагента с катализатором, дающего отдельную кристаллическую фазу, как правило, каталитически неактивную. Например, при окислении S02 в S03 на оксиднованаДиевом катализаторе сильное повышение концентрации диоксида серы приводит к образованию
кристаллов сульфата ванадила V0S04. Энергия активации реакции при этом возрастает более чем в 2 раза.
Повышение концентрации продукта Сп обычно тормозит общую скорость реакции, так как при этом сдвигается адсорбционное равновесие и увеличивается поверхность катализатора, занятая продуктом. При катализе на пористых зернах катализатора возрастание концентрации продукта увеличивает внутренние и внешние диффузионные торможения. Сильное повышение концентрации продукта для некоторых реакций приводит к отравлению контакта. В автокаталитических процессах появление продукта и рост его концентрации ускоряет реакцию (рис. 1.3).
Повышение концентрации примесей Сприм всегда снижает скорость реакции, однако градиент этого снижения в присутствии инертных по отношению к катализатору примесей невелик, в то время как незначительное содержание контактных ядов вызывает падение активности в несколько раз (см. рис. 2.26).
Температура среды Т оказывает значительное влияние на скорость процесса, протекающего как в кинетической, так и в диффузионной областях. Температура в кинетической области влияет на константу скорости согласно уравнению Аррениуса (1.6).
Если известна константа скорости реакции при Тх, то для расчета константы k2 при Т2 в небольшом температурном интервале, соответствующем неизменной энергии активации Е, применяют формулу Аррениуса в виде:
При значительной разнице температур может измениться и энергия активации вследствие химических превращений катализатора (во взаимодействии со средой) или же структурных его изменений.
В диффузионной области k является функцией коэффициента диффузии.
Молекулярная диффузия зависит от температуры:
D = агТп, (1.25)
Где п = 1,5-7-2,2 [25].
В области диффузии Кнудсена:
°к = а2Т°'5- (1-26)
При постоянстве всех параметров (кроме Т), входящих в уравнения (1.14) и (1.9), размерные коэффициенты аг и а2 также постоянны. Температурный коэффициент скорости процесса
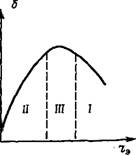
Рт = ^т+ю/^т (1-27)
В кинетической области изменяется в зависимости от температуры и энергии активации (рис. 1.4). В диффузионной области значение рт в несколько раз меньше, чем в кинетической. При обычных
Рис. 1.4. Зависимость температурного коэффициента реакции Рт от температуры и энергии активации
|
І I I |
Е, Дж/моль: 1 — 336; 2 — 252; 3 — .168; 4 — 84
Температурах диффузионный температурный коэффициент рд. т = 1,1ч-1,8.
|
1 Q. I |
Увеличение давления в газовой среде влияет на активность так же, как и повышение концентрации реагентов. При ' возрастании давления может измениться порядок реакции. Коэффициент молекулярной диффузии, согласно уравнению
(1.9), обратно пропорционален давлению, a DK не зависит от давления [см. уравнение (1.14)].
Ряд каталитических синтезов проводят при повышенном и высоком давлениях главным образом с целью смещения равновесия в сторону продукта. При этом давление влияет и на кинетику [30].
Структурные характеристики катализатора (SyH, d3. Ср, гэ) оказывают сложное взаимосвязанное влияние на активность катализатора.
В кинетической области при равномерном распределении активных центров по поверхности катализатора его активность. Лкат (или константа скорости каталитической реакции &кат) пропорциональна 5уд:
Лцат = "^уд - С1 ■ 28)
Однако
SyA = a2/C. (1.29)
|
(1.286) |
Следовательно
(1.28а)
Во внутридиффузионной области при кнудсеновской диффузии
Ап = а4г",
Так как увеличение размера пор ускоряет диффузию по уравнению (1.14). Однако уравнение (1.29) сохраняет справедливость. Естественно, что уравнения (1.28), (1.28а), (1.28, б) и (1.29) справедливы при постоянстве всех других параметров, входящих в формулы (1.9)—(1.14) и функциональную зависимость (1.22). Величины аг—at обобщают постоянство этих параметров.
|
15 г |
|
|
|
10 |
|
100 200 300 400 Температура °С |
|
500 |
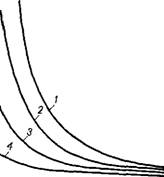
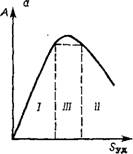
В результате диалектического противоречия во влиянии 5УД и гэ на А при постоянстве d3. ср активность изменяется экстремально, согласно графиков на рис. 1.5, так как показатели сте-
|
|
Рис. 1.5. Зависимость активности катализатора от удельной поверхности (а) и радиуса
Пор ((Г):
|
|
I — кинетическая область; // — диффузионная область; /// — переходная область
Пени тип изменяются от 1 до —1, проходя через 0 в переходной области от кинетической к диффузионной, т. е. в области сопоставимости константы скорости реакции и коэффициента диффузии, отнесенного к длине I поры, которую можно выразить через г9 или d.
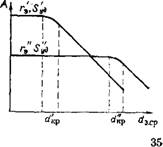
Совместное воздействие Sуд, ср и гд показано на рис. 1.6. Рис. 1.5 и 1.6 показывают, что в кинетической области более активны тонкопористые катализаторы. Однако при увеличении размера зерна внутридиффузионное торможение для тонкопористых катализаторов (г'3) начинается раньше, чем для крупнопористых (г'з), т. е. d'Kр < dip (см. рис. 1.6). Во внутридиффузионной области более высокую активность могут проявлять крупнопористые катализаторы.
Увеличение линейной скорости потока w приводит к уменьшению и затем полному снятию внешнедиффузион- ных торможений, т. е. к увеличению активности только во внешне - диффузионной области. Однако одновременно снижается движущая сила процесса АС вследствие осевого перемешивания исходных веществ с продуктами реакции.
|
|
Молекулярные массы исходных веществ Мя, М'к... и продуктов Мп имеют определяющее влияние на активность катализатора во внешне - и особенно во внутридиффузионной областях, т. е. когда, согласно уравнениям (1.8), (1.9) и (1.14), k = bxD и D = b2!VМ 1Ьг и b2 — размерные коэффициенты, зависящие от ряда параметров уравнений (1.9) и (1.14) І.
Вязкость среды ц не играет существенной роли при катализе газов, но в жидкофазном катализе, когда
Рис. 1.6. Зависимость активности катализатора от размера зерен при разных размерах nop (г'э < гэ;
5УД < 5уд)
У
Лимитируют диффузионные стадии процесса, его константа скорости по формуле (1.12) обратна вязкости.
Следует отметить, что высотаидиаметр слоя контактной массы, а также конструктивные параметры аппарата влияют на гидродинамику процесса, а через нее и на активность катализатора во внешнедиффузионной области.
Для многомаршрутных параллельных реакций и последовательных превращений, особенно характерных для процессов органической технологии, не меньшее значение, чем активность, имеет селективность (избирательность I) действия катализаторов. Из ряда термодинамически возможных реакций селективный катализатор должен ускорять лишь реакцию получения целевого продукта. В результате температура целевого превращения понижается и побочные реакции подавляются.
Примером избирательного действия катализатора является процесс окисления аммиака в производстве азотной кислоты. Возможно несколько параллельных и последовательных реакций: 4NH3 + 302 = 2N2 + 6Н20 + 1300 кДж, (а)
TOC \o "1-3" \h \z 4NHS + 402 = 2NaO + 6Н20 + 1100 кДж, (б)
4NHS + 502 = 4NO + 6Н20 + 900 кДж, (в)
2NO—*N2 + 02 — Q. (г)
Однако платиновый катализатор весьма селективно ускоряет целевую реакцию (в), понижая температуру ее протекания, в то время как параллельные реакции (а) и (б) подавляются, несмотря на то, что термодинамически они более выгодны. Также подавляется и реакция (г), для быстрого прохождения которой необходимы более высокие температуры.
Для простейшей бимаршрутной реакции типа:
Где А — основное исходное вещество, по которому определяют выход целевого продукта В,
Селективность можно рассчитать по формуле:
/ =______ (1.30)
B/a(-dGA)
Здесь бд и (їв выражены в молях.
Общую (интегральную) селективность действия катализатора можно выразить отношением числа молей целевого продукта (например, GB) к общему числу молей целевого и побочных продуктов:
' = <Ъ/(св+сд)- (К31)
Селективность зависит от тех же параметров, что и активность [см. зависимость (1.22)], но характер влияния параметров несколько отличается. Селективность, как правило, снижается с увеличением времени контакта реагентов с катализатором (понижением объемной скорости), особенно для реакций, в которых целевой продукт является промежуточным в цепи последовательных превращений (аА -*■ ЬВ -*■ dD).
Достижение равновесия в системе, направление реакции и выход продуктов в значительной степени определяются объемной скоростью V. Последняя представляет собой отношение приведенного к нормальным условиям объема газовой смеси, проходящего за один час Vc, к насыпному объему катализатора v:
V = Vc/v. . (1.32)
Определение активности и селективности отдельных катализаторов усложняется тем, что они могут изменяться в течение процесса под влиянием температуры и среды.
Взаимодействие между катализатором и средой не ограничивается влиянием катализатора на реагенты, а, как отмечено выше, имеется и обратная связь между средой и катализатором. Строго можно лишь говорить о каталитической активности всей системы в целом, включающей контактную массу и реакционную смесь [19—30]. В катализаторе под влиянием среды могут изменяться: состояние поверхности; структурные характеристики контактной массы; химический состав и, следовательно, свойства всего объема катализатора без образования новых фаз (растворение кислорода, водорода, азота); химический состав с образованием новых фаз (образование оксидов металлов в реакциях окисления, сульфатов при окислении S02 в'SOj).