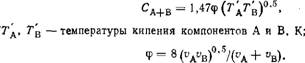ОБЩИЕ СВЕДЕНИЯ О КАТАЛИЗЕ И КАТАЛИЗАТОРАХ
Катализом называют увеличение скорости химических реакций или возбуждение их в присутствии катализато - р о в, которые участвуют в реакции, вступая в промежуточное химическое взаимодействие с реагентами, но восстанавливают свой химический состав при окончании каталитического акта. Обычно катализатор многократно вступает в такое взаимодействие, повышая скорость химической реакции в течение длительного вре - мени и образуя продукты реакции, масса которых может превосходить массу самого катализатора в тысячи раз.
Если процессы катализа рассматриваются применительно к производственной практике, то используют термин «промышленный катализ». В теории катализа описывается механизм и кинетика каталитических реакций на молекулярном и ионном уровне (микроуровне), в промышленном же катализе, который здесь излагается, изучается макрокинетика, т. е. кинетика каталитических процессов, включающих собственно химическую реакцию л стадии подвода реагентов в зону реакции и отвода продуктов •(диффузионные процессы).
Катализ может нарушиться в результате изменения состава и структуры катализатора, происшедшего из-за побочных химических реакций или механических и температурных воздействий. При возбуждении разветвленных цепных реакций, в частности реакций, приводящих к взрыву, возможно в принципе и однократное участие катализатора в химической реакции.
Энергия Гиббса катализатора до акта катализа и после него неизменна. Поэтому в одномаршрутных обратимых реакциях катализатор ускоряет достижение равновесия, но не смещает его.
Константа равновесия К любой химической реакции определяется изменением энергии Гиббса Ag при данной абсолютной температуре Т:
\nK = bg/(RT), (1.1)
Кроме того
Ag = TAS — АН. (1.2)
|
19 |
Здесь R — газовая постоянная, равная 8,315 Дж/(моль-К); А5 — изменение энтропии системы, Дж/(моль-К); — изменение энтальпии, т. е. тепловой эффект реакции, обычно обозначаемый в технологии Дж/моль.
2*
Ускоряющее действие катализаторов весьма специфично и сильно отличается по эффективности и механизму воздействия от влияния других параметров процесса. Как известно [18, 19], скорость технологического процесса можно повышать, изменяя температуру, давление, концентрацию реагентов, применяя перемешивание реагирующих масс и катализаторов.
Скорость процесса и выражают изменением количества продукта Gn, его концентрации Сп и степени превращения х основного исходного вещества во времени т. Соответственно уравнение скорости процесса в проточных реакторах для процессов, протекающих при незначительном осевом (продольном) перемешивании реагентов с продуктами реакции [19], будет иметь вид:
= (13)
|
И = -^- = £ДС. (1.3a) |
Dx v di v '
ИЛИ
Ft - ---
Dx
Здесь v ■— реакционный объем (в гетерогенно-каталитических процессах — насыпной объем катализатора); k — константа скорости процесса; ДС — движущая сила процесса (произведение действующих концентраций реагирующих веществ).
Движущую силу процесса можно увеличить, повышая концентрации реагентов С и давление Р до оптимальных значений. Перемешивание приводит к увеличению k только в случаях медленной диффузии реагентов в зону реакции. Температура — наиболее универсальное средство интенсификации технологических процессов, повышение ее ускоряет химические реакции и в меньшей степени диффузию. Однако рост температуры ограничен термостойкостью материалов и в обратимых экзотермических процессах приводит к уменьшению АС. Таким образом, интенсифицирующее действие всех параметров технологического режима, за исключением действия катализаторов, возможно лишь до определенного предела.
Катализаторы могут неограниченно повышать k, не влияя на АС [см. уравнения (1.3) или (1.3а)]. Применение катализаторов — наиболее эффективный прием интенсификации химических процессов. Однако в отличие от действия температуры катализаторы не влияют на скорость диффузии. Поэтому во многих случаях при значительном повышении скорости реакции суммарная (общая) скорость остается низкой из-за медленного подвода компонентов в зону реакции.
Каталитический процесс представляет собой совокупность каталитических реакций на поверхности катализатора с процес* сами подвода реагентов в зону реакции и отвода продуктов реакции.
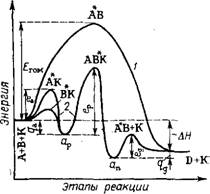
Рис. 1.1. Изменение энергии реагирующей системы при некаталитической *
А + В -»- АВ ч - D (/) и каталитической (2) экзотермической реакции по модели Ленгмюра—Хиншельвуда:
*
І АВ — гомогенный активированный
Комплекс; £ром — энергия активации *
Образования АВ; еа — энергия активации активированной адсорбции более трудно сорбируемого исходного компонента; ед — энергия активации десорбции продукта; ер — энергия активации образования активированного комплекса (реакции); qa — теплота экзотермической адсорбции; qд — теплота экзотермической десорбции; АН — общее изменение энергии в реакции, т. е. разность эитальпнй реагентов и продукта экзотермической реакции;
Ор и ац — адсорбированные реагенты н продукты реакции
В общем случае катализ на твердых пористых катализаторах складывается из следующих элементарных стадий:
1. Эффективная внешняя диффузия реагирующих веществ из. ядра потока к поверхности зерен катализатора. При этом ко э ф - фициент эффективной диффузии D3 является функцией коэффициентов нормальной (молекулярной) диффузии Оитурбулентной (конвективной) диффузии DT. Последний называют также коэффициентом перемешивания, так как действительно выражает конвективный перенос вещества, вызванный турбулентным движением потока в слое катализатора.
2. Эффективная внутренняя диффузия в порах зерна катализатора. В зависимости от соотношения размеров пор и молекул газов внутренняя диффузия может проходить по нормальному молекулярному механизму или в стесненном движении по механизму Кнудсена. Она может быть функцией Оикоэффици - ента диффузии Кнудсена DK.
3. Активированная (химическая) адсорбция одного или нескольких реагирующих компонентов на поверхности катализатора с образованием поверхностного химического соединения (рис. 1.1).
4. Перегруппировка атомов с образованием поверхностных комплексов продукт—катализатор.
5. Десорбция продукта катализа (регенерация активного центра катализатора).
6. Диффузия продукта в порах зерна катализатора.
7. Диффузия продукта от поверхности зерна.
|
|
Каждая из стадий каталитического процесса должна обладать - энергией активации е, значительно меньшей, чем энергия активации гомогенной реакции Егом. В противном случае протекание - процесса каталитическим путем может оказаться энергетически невыгодным.
Общая скорость гетерогенного каталитического процесса определяется относительными скоростями отдельных стадий и может лимитироваться наиболее медленной из них. Иногда скорость всего процесса определяют химические превращения (стадии 3, 4, 5) на поверхности катализатора, а иногда — диффузионные переносы веществ [20]. Говоря о стадии, лимитирующей процесс, мы предполагаем, что остальные стадии протекают настолько ■быстро, что в каждой из них практически достигается равновесие; следовательно, полное изменение энергии Гиббса в них должно быть близко к нулю. Скорости отдельных стадий определяются параметрами технологического режима.
По механизму процесса в целом, включая собственно каталитическую реакцию и диффузионные стадии переноса вещества, различают процессы, проходящие в кинетической, внешнедиффузионной и внутридиффу - зионной областях.
В общем случае константа скорости процесса в уравнениях (1.3) или (1.3а)
K = f(kl, ki, kao6,....Dm, D»,Dn...). (1.4)
Здесь ki, k2, feno6 — константы скоростей прямой, обратной и побочной реакций; DH, DH, Dn — коэффициенты диффузии исходных веществ и продукта, •определяющие значение k во внешне - или внутридиффузионной области процесса (в кинетической области k не зависит от Ои, £>н и Dn).
Общее кинетическое уравнение скорости газового каталитического процесса с учетом влияния на скорость основных параметров технологического режима:
И = k0 ехр (— E/RT) vApPn$0. (1.5)
Здесь Ар—движущая сила процесса, выраженная парциальными давлениями реагирующих веществ при Р « 0,1 МПа (1 ат); Р — отношение рабочего давления к атмосферному нормальному, т. е. безразмерное давление; (30 — коэффициент пересчета к нормальному давлению н температуре; п — общий порядок реакции.
Механизм химических стадий определяется природой реагирующих веществ и катализатора.
В кинетической области процессы (по существу каталитиче - * ские реакции) классифицируют по физической модели реакций и по типу химического взаимодействия.
Рассмотрим физические модели процесса на примере типичной
Реакции синтеза, которая без катализатора протекает по уравне - * *
Нию А + В -»- АВ -»- D, где А и В — исходные вещества; АВ — гомогенный активированный компонент; D — продукт реакции. На твердом катализаторе возможны два механизма [9, 21 ]:
1) по модели Ленгмюра — Хиншельвуда — б стадии 3 адсорбируются А и В, а затем происходит реакция между адсорбированными компонентами;
2)по модели Ридила адсорбируется один компонент (например, А), причем нарушаются связи атомов в молекуле и налетающие из газовой (или жидкой) фазы молекулы реагента В - сорбируются на катализаторе через молекулу (радикал) А (ударный механизм).
I Если лимитирует общую скорость процесса стадия 4 (перегруппировка атомов), то по модели Ленгмюра схема каталитического процесса синтеза в кинетической области имеет вид:
1)а + кї=їак; 2) b + kz^bk;
3) АК + ВК —АВК; 4) АВК+ К -
Здесь К ~ активный центр катализатора.
Графически изменение энергетического состояния системы на основе модели Ленгмюра по стадиям реакции представлено на рис. 1.1. В данном примере Егом > ер > еа > ел. В принципе-
Возможно, что еа >. ер, тогда стадия 1 будет неравновесна, а на
*
Рис. 1 продукт активированной адсорбции АК будет иметь наибольший максимум.
Стадии модели Ридила для тех же условий:
1)А + К5^АК; 2) АК + В —>-ВАК; 3)BAKi=tD+K.
Соответственно график будет отличаться от рис. 1.1.
По модели Ридила происходит, например, синтез аммиака на железном катализаторе, где активированно адсорбированный азот гидрируется налетающими молекулами водорода, так же - протекает окисление диоксида серы на платине [28] и ряд других реакций.
При построении и анализе графика энергия — этапы реакции следует иметь в виду, что каталитическое ускорение реакции определяется наименьшей разностью (Егом — е); для рис. 1.1 разностью Етом — ер.
Как видно из физических моделей катализа, сущность ускоряющего действия катализаторов состоит в понижении энергии активации Е химической реакции в результате изменения реакционного пути при участии катализатора или вследствие осуществления реакции по цепному механизму при инициирующем действии катализатора. Однако в некоторых типах каталитических реакций одновременно с понижением Е происходит уменьшение предэкспоненциального члена k0 в уравнении Аррениуса:
Ft = ft0exP [—£/(ЯГ)]. (1.6>
Вследствие чего повышение константы и соответственно скорости реакции при использовании катализатора несколько уменьшается по сравнению с ожидаемым на основе снижения Е.
Рассмотрим сущность k0. Скорость любой реакции зависит от числа эффективных столкновений активированных молекул с обычными, а вероятность соударений — от длительности активации та и концентрации молекул. Вычислено, что та ~ — 10 9 с, а интервал времени между соударениями составляет - 10"e—10~9 с; это обеспечивает протекание реакции с нормальной для производственных условий скоростью.
В активации играет роль как кинетическая, так и внутримолекулярная энергия. Если общая энергия молекул превосходит Е, необходимую для реакции, то молекулы возбуждаются. При этом повышается не только скорость движения молекул, но и энергия колебания составляющих молекулу частиц. Изменяется электронное состояние молекулы, так как электроны переходят на более высокие энергетические уровни.
Расчеты, проведенные по теории столкновений, совпадают с экспериментальными данными лишь для быстрых реакций в узком температурном интервале. В случае медленно текущих реакций получаются большие расхождения, поэтому в уравнение Арре - ниуса введена дополнительная величина р — пространственный фактор (фактор вероятности), показывающий отклонение значения k действительной реакции от идеальной (р < 1):
K = pZ exp [— E/(RT)]. (1,6a)
Здесь Z — число сталкивающихся молекул, равное
Z = 6A8BY8nkBT(l/MA+l/MB), (1.7)
Аа> ^в — Диаметры молекул А и В; МА, Мв — молекулярные массы молекул А и В; Sj — постоянная Больцмана, равная R/N (R — газовая постоянная; N — число Авогадро).
Вследствие экспоненциальной зависимости k от Е при значительном снижении Е влияние уменьшения! ій не имеет существенного значения.
Для осуществления реакций с достаточной скоростью в производственных условиях необходимо, чтобы энергия активации ■была, как правило, меньше 170 кДж/моль основного вещества. Для рентабельного получения некоторых продуктов требуется снижение Е до 40 кДж/моль. Между тем ряд важных для народного хозяйства реакций происходит гомогенно лишь при энергиях активации более 209 и даже более 300 • кДж/моль. В частности, к таким реакциям относятся окисление диоксида серы и аммиака, т. е. реакции, определяющие возможность производства серной [12] и азотной [14] кислот.
Применение катализаторов дает возможность понизить Е до значений менее 170 кДж/моль. Так, при гомогенном окислении SOa без катализатора Е > 280 кДж/моль, на платиновом катализаторе Е <С 70 кДж/моль и на ванадиевом Е « 90 кДж/моль S02. При окислении аммиака на платиновом катализаторе Е = = 34 кДж/моль, вследствие чего общая скорость процесса определяется скоростью диффузии аммиака и кислорода к поверхности катализатора. Для ферментативных реакций, как правило, Е = 35^-50 кДж/моль.
Обычно энергию активации находят по опытным кинетическим данным, рассчитывая по уравнениям типа (1.3), (1.3а) константу
Скорости и затем строя в арреииусовских координатах [уравнения (1.6) или (1.6а)] график lg k— l/Т. При этом по наклону зависимости определяют кажущуюся энергию активации. При /экзотермической адсорбции (см. рис. 1.1) кажущаяся энергия активации ер больше истинной: ер = ер. и + qa.
Одновременно со снижением энергии активации во многих случаях уменьшается порядок реакции. Так, гомогенное некаталитическое окисление S02 происходит по реакции третьего порядка (га = 3) : 2S02 + 02 = 2S03. При обычных производственных условиях каталитического окисления на малоактивном оксид - ножелезном катализаторе (Е = 120-=-160 кДж/моль S02) га = = 2,5, на более активном ванадиевом катализаторе га = 1,8, а на самом активном платиновом катализаторе га = 1 [22].
Понижение порядка реакции объясняется тем, что в присутствии катализатора реакция идет через несколько элементарных стадий, порядок которых может быть меньше порядка некаталитических реакций. Различное влияние скорости элементарных стадий на общую скорость каталитической реакции нередко приводит к дробному ее порядку.
По типу химического взаимодействия различают гемолитический и гетеролитический катализ.
Гомолитический к а. т а л и з протекает по типу окислительно-восстановительного взаимодействия. Суть ускоряющего действия катализатора состоит в облегчении электронных переходов в реагирующих молекулах за счет собственных электронов катализатора. При этом, если при адсорбции молекулы исходного реагента катализатор служит донором электрона (ё), то в заключительном акте катализа он является акцептором ё, т. е. восстанавливает свой химический состав. Если на первой стадии катализатор — акцептор ё, то на последней — донор. Например, реакция окисления S02 при избытке кислорода протекает по следующим упрощенным схемам (модель Ридила): на металлическом платиновом катализаторе:
1) 03 + 2Pt 20Pt, где Pt — доиор ё,
2) OPt +S02—SO^OPt,
3) SO*OPt SOs + Pt, где Pt — акцептор ё,
На оксидножелезном катализаторе:
1) S02 + Fe203—«-SO^-FejC^, где Fe203 — акцептор ё,
2) 2S03.Fe20s+ 02^20S02.Fe20s,
3) 0S03-Fe2Os ^ SOs + Fe2Os где Fe3Os — донор ё.
Как видно из табл. 1, к гомолитическому типу относятся реакции окисления, гидрирования, дегидрирования. Характерные- катализаторы: металлы Pt, Ni, Fe, Ag и др.; оксиды переходных металлов Fe203, Сг203, V205 и др.
Гетеролитический катализ протекает по типу - кислотно-основного взаимодействия. Катализатор ускоряет реакцию, являясь последовательно донором (акцептором) протона Н+ или другого иона (например, ОН", ШРОї и т. д.), а затем его акцептором (донором). Такой катализ называют также ионным (в растворах), протонным. Типы гетеролити - ческих реакций и ряд катализаторов приведены в табл. 1.
Примером гетеролитического катализа является гидратация этилена с участием кислотного катализатора НА (Н3Р04 или H2S04):
1) СН2 = СН3 + НА CHS — + А~,
2) СН3 — СН^ + НОН CgHgOH + Н+,
Катализатор (А") служит сначала донором, а затем на стадии 3 — акцептором Н+.
Для сложных каталитических процессов, в которых необходимы гомолитические и гетеролитические катализаторы, применяют бифункциональные катализаторы (см. табл. 1). Так, в производстве бутадиена из этанола ZnO является дегидрирующей, л А1203 дегидратирующей частью контактной массы.
Каталитические реакции можно рассматривать по радикальному механизму, согласно которому при активированной адсорбции происходит расщепление молекулы реагента на радикалы. При гетерогенном катализе по модели Ленгмюра свободные радикалы, мигрируя по поверхности катализатора, образуют нейтральные молекулы продукта, которые десорбируются.
В случае гетерогенно-гомогенного катализа образующиеся радикалы переходят в свободный объем, где и продолжается цепная реакция [23]. Катализатор является возбудителем реакции.
В кинетической области протекают главным образом процессы на малоактивных катализаторах мелкого зернения с крупными порами при турбулентном течении потока реагентов, а также при низких температурах, близких к температуре зажигания катализатора. Однако для реакций в жидкостях переход в кинетическую область может происходить и с повышением температуры, вследствие снижения вязкости жидкости. Известно [24], что коэффициент диффузии компонента в жидкости Dm = а/[х, где а — коэффициент, зависящий от других параметров [см. уравнение (1.12) ]; р, — динамическая вязкость. Следовательно, увеличение температуры И СООТВеТСТВеННО СНИЖеНИе (Л ведут к ускорению диффузии. С повышением температуры уменьшается также степень ассоциации, сольватации, гидратации молекул реагентов в растворах, что приводит к росту коэффициентов диффузии и соответственно к переходу из диффузионной области в кинетическую. Для реакций, общий порядок которых выше единицы, характерен переход из диффузионной области в кинетическую при значительном понижении концентрации исходных реагентов.
Вовнешнедиффузионной области протекают прежде всего процессы на высокоактивных катализаторах, обеспечивающих быструю реакцию и достаточный выход продукта за время контакта реагентов с катализаторами, измеряемое долями секунды. В этом случае нецелесообразно применять пористые зерна с высокоразвитой внутренней поверхностью, а нужно стремиться развить наружную поверхность катализатора. Так, при окислении аммиака на платине последнюю применяют в виде тончайших сеток (см. гл. 3, стр. 159), содержащих более тысячи переплетений платиновых проволочек на 1 см2 площади сетки. Серебряные сетки или мелкие частицы (крупинки) серебра применяют при окислении метанола в формальдегид, изопропилового спирта в ацетон.
Наиболее эффективным средством ускорения процессов, протекающих в области внешней диффузии, является перемешивание реагентов, которое в реакторе данной конструкции достигается увеличением линейной скорости w потока реагентов. Сильная турбулизация потока приводит к переходу процесса из внешне - во внутридиффузионную (при крупнозернистых мелкопористых катализаторах) или же в кинетическую области.
Скорость диффузии и можно рассчитать, используя первый закон Фика, который при постоянстве условий диффузии выражается формулой:
Здесь G — количество вещества, перенесенного за время т в направлении Z,. перпендикулярном к поверхности зерна катализатора при концентрации С диффундирующего компонента в ядре потока реагентов; S — свободная внешняя
Площадь поверхности зерен (гранул, проволок) катализатора; — градиент-
Концентрации.
Предложено большое число способов и уравнений для определения коэффициентов диффузии веществ в различных средах [24, 25]. Для расчета коэффициента молекулярной диффузиц в газовой среде Кафаров [25] рекомендует полуэмпирическое уравнение Арнольда, которое дает отклонение от опытных данных не более 21 %. Другие уравнения [24—26] дают большие отклонения.
Для бинарной смеси веществ А и В по Арнольду
_ 0,008377і 5/12 yri/MA+ 1 /Мв ~ P(v^+v^y(T + CA+B) ' (L9)
2Г
Для газов А и В с близкими значениями vA, vB можно принять ф = 1; при значительном различии молярных объемов ■ф < 1. Значения vA и ив можно определить опытным путем или рассчитать по атомным объемам [25].
|
(1.12) |
Коэффициент диффузии в жидких средах '(м2/с) можно ■определить по формуле [25]:
Ож = 7,4 - Ю-8 (хаM)V2T/(iiv0-6).
Здесь ха — параметр, учитывающий ассоциацию молекул в растворителе; М и v — молярные масса и объем диффундирующего вещества соответственно; ц— вязкость растворителя, Па-с.
Параметр ха имеет следующие значения:
Растворитель.... Вода Метанол Этанол Бензол
(эфир)
Ха.................................. 2,6 1,9 1,5 1,0
Для расчета Dm применяют и другие уравнения [19, 25, 26]. Следует отметить, что D = (104-М05) Ож, если обычно D = 0,1 Н-1,0 см2/с, то Dx « 1 см2/сут. Отсюда следует, что принудительное перемешивание в жидких средах особенно необходимо.
Коэффициенты турбулентной диффузии можно ориентировочно оценить совместным решением уравнения второго закона Фика с гидродинамическими уравнениями Навье—Стокса и неразрывности потока [24]. Практически в работающих реакторах всегда происходит перемешивание, поэтому наиболее точно суммарный коэффициент диффузии Da или же количество G диффундирующего вещества определяют опытным путем, а затем эти данные переносят на моделируемый процесс с помощью критериальных уравнений.
|
Здесь Лід, Мв Уд, t'B — молярные массы (г/моль) и молярные объемы <(см3/моль) веществ А и В соответственно; Р — общее давление (0,1 МПа); СА_|_В — константа Сезерленда:
|
|
(1.10) |
|
(1.11) |
Вовнутридиффузионной области, т. е. когда общая скорость процесса лимитируется диффузией реагентов в порах зерна катализатора, существует несколько путей ускорения процесса. Можно уменьшать размеры зерна катализатора и соответственно путь молекул до середины зерна; это возможно, если одновременно переходят от фильтрующего слоя катализатора к кипящему. Можно изготовить для неподвижного слоя крупнопористые катализаторы, не уменьшая размеров зерен во избежание роста гидравлического сопротивления, но при этом неизбежно уменьшится внутренняя поверхность и соответственно понизится интенсивность работы катализатора по сравнению с мелкозернистым тонкопористым. Можно применять кольцеобразную
контактную массу с небольшой толщиной стенок. Наконец, можно готовить бидисперсные [20] или полидисперсные (мультидисперс - ные) [27, 28] катализаторы, в которых крупные поры являются транспортными путями к высокоразвитой поверхности, создаваемой тонкими порами малой длины (глубины).
Во всех этих случаях стремятся настолько уменьшить глубину проникновения реагентов в поры (и продуктов из пор), чтобы ликвидировать внутридиффузионное торможение и перейти в кинетическую область, когда скорость процесса определяется только скоростью собственно химических актов катализа, т. е. адсорбции реагентов активными центрами катализаторов, образования продукта и его десорбции.
Большая часть промышленных процессов, проходящих в фильтрующем слое, тормозится внутренней диффузией. В частности, такими являются крупномасштабные каталитические процессы конверсии метана с водяным паром, конверсии оксида углерода, синтеза аммиака, окисления диоксида серы, окисления нафталина и т. д.
Время т, необходимое для диффузии компонента в поры катализатора на глубину I, можно определить из формулы Эйнштейна:
Т=>/(20в). (1.13)
Эффективный коэффициент диффузии в порах определяют приближенно в зависимости от соотношения размеров пор и длины свободного пробега молекул. В газовых средах при длине свободного пробега К молекулы компонента, меньшей эквивалентного диаметра поры d = 2г (А, < 2г; г — радиус поры), принимают, что в порах происходит нормальная молекулярная диффузия, и вычисляют Dg — D по формуле (1.9) или другим формулам [24, 25].
При стесненном режиме движения, когда А, > 2г, определяют D3 ~ DK по ориентировочной формуле Кнудсена:
DK = *l3rVmTl{nM). (1.14)
При Я = 2г
D3 = D[1—ехр(—2гД)]. (1.15)
Диффузия в порах катализатора в жидких средах весьма затруднена вследствие сильного повышения вязкости растворов в узких каналах (аномальная вязкость). Поэтому для катализа в жидкостях часто используют дисперсные катализаторы.
Все приведенные выше формулы [(1.9)—(1.15)] применяют не только для вычисления абсолютных значений D3, но и для оценки влияния основных параметров технологического режима (входящих в эти формулы) на скорость процесса. Во многих каталитических процессах с изменением состава реакционной смеси и других параметров процесса может меняться механизм катализа, а также состав и активность катализатора, поэтому необходимо учитывать возможность изменения характера л скорости процесса даже при относительно небольшом изменении его параметров.
Ввиду трудности определения константы скорости процесса - в данных конкретных условиях как функции частных констант и коэффициентов диффузии [см. уравнение (1.4) ], особенно в переходной области, т. е. при сопоставимых скоростях химических и диффузионных стадий, в практике предпочитают определять общую константу скорости k опытным путем и затем рассчитывать, скорость процесса по уравнениям типа (1.3) и (1.3а) или (1.5).