Равновеоне жидкость—пар в системе NH,—СО,—Н.,0
Свои эксперименты японские исследователи [33 I проводили в статическом автоклаве, оборудованном магнитной мешалкой и пробоотборниками жидкой и паровой фаз. После загрузки исходных реагентов в охлажденный до низкой температуры автоклав реакционную смесь замораживали и быстро откачивали воздух. Затем автоклав помещали в обогреваемый термостат для обеспечения и поддержания заданных температур. В каждом опыте температуру устанавливали на таком уровне, чтобы обеспечить в автоклаве Р = 1,96 МПа, и при таких параметрах выдерживали перемешиваемую реакционную смесь в течение 3 ч от момента стабилизации температуры и давления. Затем отбирали пробы жидкости и пара для определения равновесного содержания NH8, С02 и Н20 хроматографическим методом.
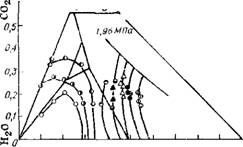
На рис. III.4 приведены построенные по полученным экспериментальным данным изотермы растворимости для системы NH3 — С02—Н20. По этим же данным были вычислены [33] коэффициенты активности компонентов системы NH3—С02—НаО в жидкой 114
Фазе и составлены обобщенные эмпирические уравнения.
|
NH4HC0. |
|
Nh4coon% |
|
0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0.9 1,0 Н20 NH3 |
|
Рис. iii.4. Изотермы растворимости для системы NН3—С02—Н20 при Р = 1,96 МПа и Г К: |
Обозначив давление насыщенного пара компонента как Р°, общее давление системы как л, коэффициенты активности Уі вычисляли по уравнению
|
Y; = |
|
Здесь |
2,In \( NЈ X,
|
Lg |
|
2,303RT (III.4) 0,197 — 0,012Г/г |
|
Ю\ |
|
Кр |
|
(111.5) (111.6) |
® — 342 — 345; • — 353 — 355; д — 363; А — 372; О — 373; О — 383; О — 393; О — 403; О — 413.
0,4 0,146
|
£ кр М, р і |
|
Vi, |
|
У, і |
(III.7)
|
Вычисленные значения lg |
Где Ві — второй вириальный коэффициент компонента i; Vim — мольный объем компонента в жидкой фазе; Nh X,- —мольные доли компонентов в газовой и жидкой фазах; R ■— газовая постоянная; Т—абсолютная температура; Тіг—приведенная температура; Тікр—критическая температура; Я,-Кр— критическое давление; Mh р,-, —соответственно молекулярная масса, плотность и коэффициент расширения. Верхний индекс «штрих» относится к характеристикам при стандартной температуре.
Были аппроксимированы в за
Висимости от \!Т в виде уравнений [33]: для 70—140 °С
|
1995 |
|
І8- |
|
(III.8) |
|
— 4,140 |
НгО
|
923,8 |
|
"NH. |
|
Lg- |
|
-2,8 |
|
Р0 1 NH. |
(III.9)
Для 100—140 °С
|
621 = - у —2,079 |
|
'NH. |
|
(ІІІ. І0) |
|
Р 0 1 NH, |
|
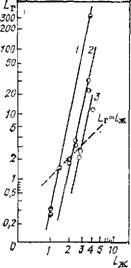
Рис. II 1.5. Зависимость Lr от Lm при постоянной температуре: |
По результатам расчетов yt получены следующие эмпирические уравнения (температурный интервал 100—140 °С) [33]: 1§Тын3= ' -
|
■3,348б4О!-0,7058ХынХСО2 |
|
1 — 393 к — в (вычисленные), о (измеренные); 2 — 403 к — о (вычисленные), о (измеренные); 3 — 413 к — О (измеренные). |
-0,4384О2 + 0,450Х2н - 10.0ХСО XHj0
С02 + 3'[12]^Н2О)2
(III.11)
0,00859Х^Н
Lco
(XHiO + 0,2675XNHi - 1,283Xc
(III.12)
С помощью этих уравнений, а также уравнения (III.3) можно вычислить JVnh3 и Nн2о» а Nсо2 = 1 — (Мин, + ЛГн, о)-
На рис. III.5 приведен график зависимости между отношениями мольных концентраций NH3 и С02 в паровой (Lr = NhhJN сог) и жидкой (Lm = = XNH3/Xco2) фазах, построенный по экспериментальным и расчетным данным [33]. Пунктирная линия соответствует азеотропной смеси (Lr = Lm). Как видно из рис. II 1.5, состав азеотропной смеси в тройной системе определяется только отношением мольных концентраций NH3 и С02 (Ln!)\ при 120, 130 и 140 °С Ln. соответственно равно 1,5, 2,0 и 3,0, т. е. с повышением Т Lm увеличивается.
Используя дополнительно экспериментальные данные по фазовому равновесию в системе NH3—С02—Н20 в интервале температур 70—99 °С [33], авторы этой работы составили эмпирические уравнения, которые охватывают весь изученный температурный интервал (от 70 до 130 °С):
|
'2 vnh, ~ ' 'йТн. о^- Здесь |
|
(ХЫНз-3,694ХС0а-2,887ХН20)3 + СПХ |
|
■ 0,00349Л^Н |
|
+вохсо2 |
|
O'[13]Nh3*co2 |
|
(XH2O-0,3464XNHs + 1,280XCO2)2 |
|
-3.694Л' — 0,7382 ,637Л' 0934 3143 |
|
Во- |
|
С0 = — 0,2708А' + |
|
А' = 8,909 |
|
(при 70 — 95 °С) |
|
Т 5276 |
|
А' = 14,705 |
|
(при 95— 130 °С) |
" 1.0774 0> +0,0839Х2н2О + Л0ХСО Хн,0
(111.13)
Судя по таблицам, помещенным в работах [33], результаты расчета по приведенным выше обобщенным уравнениям удовлетворительно согласуются не со всеми экспериментальными точками. К тому же число опытных данных, положенных в основу уравнений, весьма ограничено. Поэтому вопросы о возможностях использования обсуждаемых уравнений для расчета состава фаз системы NH3 —С02—Н20 и степени точности таких расчетов нуждаются в дополнительном изучении.