Кинетика процесса в промышленных реакторах Синтеза карбамида
Исчерпывающий обзор работ по кинетике синтеза карбамида приведен в книге [1]. Затем были опубликованы результаты исследований [32, 33].
^ Автор [32] проводил свои опыты в изотермических условиях на проточном реакторе змеевикового типа по аналогии с исследованием [34 ]. По результатам экспериментов были построены графики зависимости х от t, Р, L, W, скорости подачи реакционной смеси, времени пребывания смеси в реакционной зоне тп. Причем параболические кривые х — t в большинстве случаев доведены до t, при которой х = 0. Считается, что в зависимости от величины Р процесс протекает в диффузионной либо в кинетической области. Приведено измеренное при L = 3,5; W = 0, t = 200 °С и Р = = 40 МПа среднее по объему реактора значение ргм, которое составило 0,9 г/см3. Установлено, что с увеличением скорости движения реакционной смеси через изотермический трубчатый реактор улучшается гидродинамическая обстановка и величина х растет. Представляют интерес приведенные данные о кинетике
Синтеза в начальный период (при ти порядка 1—3 мин), так как в опытах в статических автоклавах этот участок кинетических кривых бывает неизбежно искаженным. К сожалению, подавляющее число экспериментальных данных получено при 25—40 МПа, тогда как в действующих цехах величина Р, как правило, составляет 18—23 МПа. Кроме того, автор не приводит математического описания кинетики синтеза, которое можно было бы использовать для решения практических задач по усовершенствованию и оптимизации промышленных агрегатов.
Авторы [33 ] изучали кинетику реакции синтеза карбамида при постоянном объеме, давлении до 100 МПа и температуре до 220 °С на установке, позволявшей фиксировать скорость процесса и давление в реакторе для одного и того же момента времени при перемешивании реакционной смеси. Усредненные результаты более, чем 600 опытов, представлены ими в виде сопряженных кинетических кривых х — ти Р — т. Методика опытов и описание экспериментальной установки изложены в публикациях [33]. Некоторые итоги этих исследований были приведены выше в гл. I.
При обработке кинетических данных исходили [33] из того, что скорость процесса лимитируется скоростью реакции дегидратации карбамата аммония, которая в прямом направлении имеет первый порядок, а в обратном — второй. С учетом этого найдено полуэмпирическое уравнение (1.51) кинетики синтеза для периодического процесса и непрерывного процесса, протекающего в аппарате идеального вытеснения.
Установлено [33 ], что константа скорости существенно зависит от интенсивности перемешивания газожидкостной смеси, причем с увеличением температуры эта зависимость усиливается. При достаточно большом значении числа обменов поверхности контакта жидкой и газовой фаз в реакторе в единицу времени (v) константа скорости может достигать максимальной величины, неменяющейся с увеличением интенсивности перемешивания. Из этого следует, что реакция синтеза карбамида имеет диффузионную и кинетическую области.
|
(11.25) |
На рис. II.3 величины константы скорости kc даны в координатах
Lg kc = А —^
Из рисунка видно, что температурная зависимость константы скорости имеет две области, отвечающие относительно низкой (при высоких температурах) и высокой энергиям активации. Значения коэффициентов А и В из уравнения (11.25) представлены для обеих областей в табл. II.5. Температуры, отвечающие точкам перелома на рис. II.3, при различных v со средним отклонением менее 1,5° описываются следующим уравнением:
(11.26)
|
4046,5
|
~0,5р где Т* — температура гра
Ницы перехода из одной температурной области в другую, к.
,-/0(- \ Интенсивность перемеши
Вания газожидкостной смеси сказывается лишь на величине свободного члена Л в уравнении (И.25), но не В, отражающего наблюдаемую энергию активации процесса. При этом влияние перемешивания довольно значитель - но в обеих температурных & областях протекания реакции.
Наличие перелома кривых на рис. II.3 можно было бы объяснить сменой лимитирующей стадии химического превращения на диффузионную стадию при высоких температурах, как это обычно полагают в макрокинетике. При таком допущении наблюдалось бы резкое различие влияния перемешивания в этих двух температурных областях протекания реакции. Такого различия, однако, не наблюдалось и, по-видимому, следует полагать, что перелом прямых обусловлен (как было отмечено в гл. I) изменением механизма образования карбамида из исходных веществ. Исследования кинетики синтеза карбамида в статических автоклавах с целью определения констант скорости недостаточны для построения кинетического уравнения процесса, осуществляемого на практике в проточных колоннах при постоянном давлении. В кинетическом уравнении, справедливом для периодического процесса, недостаточно заменить переменное давление в системе на постоянное и время реакции на его эквивалент, вычисляемый по объемному расходу реагентов, чтобы получить уравнение, справедливое при протекании реакции на протоке.
|
І: З З, О JC О» |
|
4,5 |
|
-2А |
|
2,0 |
|
2,1 2,2 (і/т)-ю*,к-' |
|
Рис. II.3. Зависимость lg от обратной Температуры - у при L = 4, W = О, Рсм= 0,75 г/см3 [33]. Число обменов поверхности контакта фаз V, мин"1: 1 — 0,8; 2 — 2; 3 — 3; 4 — |
При переходе от периодического к непрерывному способу проведения реакции изменяется форма кинетического уравнения,
|
Таблица II.5 Величины А и В для уравнений (11.25) и (II.26)
|
Что обусловливается спецификой непрерывных процессов [35], хотя константы скорости, вычисленные по данным статических экспериментов, остаются прежними. Кинетическое уравнение, полученное для периодического процесса, может полностью соответствовать непрерывному проточному процессу только в одном случае, когда непрерывный процесс проводится в аппарате идеального вытеснения [35]. Кинетические уравнения одного и того же процесса, осуществляемого при прочих равных условиях в аппаратах вытеснения или периодического действия и в аппаратах смешения различаются, за исключением реакций нулевого порядка. При этом, чем выше порядок реакции, тем глубже это различие [35 Г
Для проточного аппарата
Рсм ___________ Рс»
(11.27)
VcM flcM
Где V — объем проточного реактора; VCM — объемный расход газожидкостной смеси; qCM — массовый расход реагентов на единицу объема реактора; qCo2 — то же для С02.
Подставляя (11.27) в уравнение (1.51), можно вычислить х в зависимости от qco„ при различных t, L, W и Р и интенсивности обмена поверхности фаз. Последнюю можно оценить, исходя из законов однонаправленного движения двухфазных систем [36].
Рассмотрим применимость кинетического уравнения (1.51) для непрерывного процесса синтеза в аппаратах идеального вытеснения к расчету кинетики этого процесса в действующих колоннах синтеза карбамида [33].
При постоянных t, Р, L и W = О уравнение (1.51) с учетом (11.27) принимает следующий вид:
1 , (ХХ*—Х*—Х\ const,,т ооч
У = —Lg —з—^—------------------------------------------------------------------------------------------------------- О1-28)
X \ X X* J Ясо
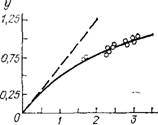
Если в рассматриваемом случае уравнение (11.28) справедливо, то значениям х, определенным в промышленных экспериментах при заданных qc0s, должна соответствовать проходящая через
Начало координат прямая линия в координатах у------------------------ —.
На рис. II.4 такая зависимость построена по данным, полученным на полой промышленной колонне синтеза карбамида. Из рисунка видно, что уравнение (11.28) не пригодно для описания проточного процесса в пустотелой промышленной колонне синтеза; следовательно, такая колонна не является аппаратом идеального вытеснения. Как уже отмечалось в гл. I, пустотелые промышленные колонны синтеза близки к аппаратам идеального смешения.
Время протекания реакции в статических условиях т связано с временем пребывания смеси в проточном автоклаве тп через 3* 67
Г]к — к. п. д. непрерывно действующего аппарата [35]. Для аппаратов идеального смешения эта связь имеет вид:
'<->! ш
ТПТ] К = Тп
Степень превращения на
Выходе из аппарата.
Интеграл в уравнении (11.29) равен левой части кинетического уравнения периодического процесса, а вид функции f (хв) нетрудно получить дифференцированием этого интеграла с подстановкой х = хв. Отсюда получено кинетическое уравнение (1.57) реакции синтеза карбамида в проточном реакторе при постоянном давлении.
|
Рис. II.4. Кинетическая кривая синтеза карбамида в проточной пустотелой колонне объемом —12 м3 при t= 190 °С, Р = = 19 МПа, L = 4,4, W = 0 в координатах уравнения (11.28). |
Для практических расчетов хв по уравнению (1.57) нужно знать прежде всего величину рсм при заданных Р, Т, L и W. Значения рсм известны только в двух случаях: на входе в колонну, когда рсы = р? м представляет собой плотность исходной реакционной смеси, и в равновесии, когда рсм = pj„ представляет собой плотность равновесной газожидкостной смеси аммиака, диоксида углерода, карбамата аммония, воды и карбамида. Величины и рсм сильно различаются. Например, при t= 190 °С, Р = 19 МПа, L = 4,4 и W = 0 р°см = 192 кг/м3 и pJM = 800 кг/м3. Поэтому получить рсм путем усреднения в интервале Рсм — р? м не представляется возможным. Из экспериментальных данных [33] следует, что отношение приращения х к приращению рсм, т. е. Лх/Дрсм, не зависит от времени. Пусть при т = 0 рсм = р°м и х = 0; при т —> оо рсм = рсм и х = х' приращений от времени не зависит, то
|
■0 |
|
X— |
Х[9] — 0
|
(11.30) |
Отсюда
_ хв / * ________ ° \ J_ °
Рсм (Рсм Рсм; "Т Рсм
Все величины, которые необходимы для совместного решения уравнений (1.57) и (11.30), легко рассчитать. Значения х* =~f1 (Р, Т, L, W), р? м = h ip> Tt L, W), Р* = /з (Т, L, рс*м) определяются обобщенными уравнениями, описанными соответственно в работах [5, 19, 27]. Величина р£„ вычисляется по правилу аддитивности по данным о плотности газообразных NH3 и С02 при заданном
давлении [37] и мольным долям этих компонентов в исходной смеси. Необходимые при расчетах значения kc в зависимости от Т, L, W, рсм приведены В ГЛ. І. По этим данным и уравнениям (1.57) и (11.30) была рассчитана кинетическая кривая реакции синтеза карбамида, протекающей в проточной колонне при t = = 190 °С, Р = 19 МПа, 1 = 4,4 и W = 0. На рис. II. 5 приведены расчетная кинетическая кривая и точки, значения которых экспериментально определены на промышленной колонне синтеза объемом ~12 м3. Соответствие экспериментальных точек и рассчитанной кривой показывает, что по уравнению (1.57) можно производить практические расчеты с удовлетворительной точностью.
|
Хв
Рис. II.5. Кинетическая кривая синтеза карбамида в проточной колонне при t — 190 °С, Р = = 19 МПа, L = 4,4, W = 0. Кривая — расчет по уравнениям (1.57) и (11.30). Точки — опытные данные, полученные на колонне объемом —12 м3. |
Во всех случаях, когда F/F0^>3, скорости потока распределяются неравномерно [41 ]. Как правило, в действующих цехах реакционную смесь вводят в полую прямоточную колонну синтеза через выносной смеситель. При этом F/Fn = 180—185 и, очевидно, неизбежен высокий градиент скорости. Аналогичная ситуация создается и в верхней части реактора, где расположен патрубок для отвода продуктов реакции.
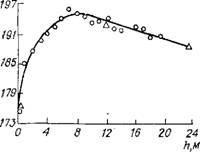
Один из важных критериев для оценки гидродинамического режима реактора — распределение температур по высоте аппарата. Кривая распределения температур для промышленного полого аппарата объемом 31,5 м3 впервые приведена в работах [39]. Соответствующие замеры были выполнены при нагрузке агрегата по С02 — 4500 м3/ч (при нормальных условиях); L = = 3,9—4,0; W = 0,5—0,8; Рс = 19,5 ± 0,5 МПа. Полученные результаты приведены на рис. II.6. Как видно из рисунка, для Vco, = 4500 м3/ч температурный максимум расположен на высоте 6—8 м при общей высоте аппарата h = 24 м. Установленный факт существования температурного максимума свидетельствует об отклонении режима от модели идеального смешения. По-видимому, скорость осевого перемешивания меньше скорости процесса образования карбамата аммония (испарение NH3 из исходной реакционной смеси, затем растворение газообразных NH3 и С02 и реакция образования карбамата аммония); поэтому температурный профиль по фактическим результатам замеров сходен с профилем, характерным для реактора идеального вытеснения. Из анализа кривой распределения температур следует также, что процесс образования карбамата аммония в реакторе синтеза карбамида протекает не мгновенно, и для его завершения требуется довольно много времени. Применительно к условиям работы реактора, при которых проводили [39] замеры температуры, среднее время пребывания смеси в реакторе составляло я^50 мин. Следовательно, процесс образования основного количества карбамата аммония завершался лишь через? к12—15 мин. Таким образом, исследование особенностей этого процесса, поиск путей его интенсификации и разработка средств оптимизации температурного режима реактора синтеза представляют собой самостоятельную и весьма актуальную задачу.
|
Tx |
|
Рис. II.6. Распределение температур по высоте реактора синтеза карбамида, полученное по замерам температур внутренней (Д) и наружной (о) поверхностей реактора. |
Гидродинамические характеристики промышленного реактора синтеза изучали методом импульсной индикации [39]. Реакцион-" 70
ная смесь в колойне синтеза представляет собой двухфазную газожидкостную систему, содержание газовой фазы в которой зависит от условий синтеза [30]. Поскольку количественные характеристики двухфазного потока не могут быть определены при раздельном учете критериев гидродинамического подобия каждой фазы, так как неизвестны доли сечений, занятые каждым из потоков [361, а основная реакция протекает в жидкой фазе, в работе [39] условно принималось, что с помощью индикатора, присутствующего в жидкой фазе, определяется общая структура потока в реакторе.
О характере распределения времени пребывания частиц потока в системе судили [39 ] по виду статистической функции распределения времени пребывания индикатора в аппарате. Последняя при нанесении импульсного возмущения имеет [38] следующий вид:
С — j хС (т) dx (11.31)
О
Где С — относительная концентрация индикатора в выходящем потоке; С (т) — функция распределения времени пребывания, характеризующая долю индикатора в выходящем потоке, время пребывания которой в системе меньше т.
Среднее значение времени пребывания определяли [39] из соотношения [38]:
| тС (т) dx
О_______
00
| С (т) dx
Где с — текущая концентрация индикатора в выходящем потоке.
Функцию распределения С (т) (с-1) рассчитывали [39] по уравнению [38]
C(t)=j----------------------------------------- c— = —jl— (ІІ. ЗЗ)
* <о 2сДт
Где Ат — интервал отбора проб; с„ — начальная концентрация индикатора во входящем потоке.
Безразмерное время пребывания 0ilp и статистическую функцию распределения времени пребывания индикатора в системе нашли [39] по уравнениям [38]:
Є„р = -1 (11.34)
|
(11.35) 71 |
Т
С = тС (т)
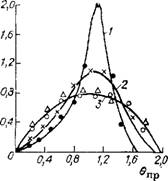
По рассчитанным величинам б„р и С построены С-кривые (рис. II.7). Для получения кривых распределения были определены [39 ] средние значения времени т и критерия Пекле, представленные ниже:
TOC \o "1-3" \h \z V'cOz- м>./ч Ре Ш1Н
4500 26,4 62,4
4800 16,1 50,4
5100 11,0 45,9
Критерий Ре может изменяться от 0 до оо, однако, в реальных расчетах принято считать, что Ре =100 соответствует режиму идеального вытеснения.
По величине Ре, учитывая также данные по распределению температур, гидродинамический режим в полом прямоточном реакторе синтеза карбамида авторы [39] отнесли к переходному. С увеличением нагрузки полого реактора, по оценке [39], гидродинамическая структура потока приближается к модели идеального смешения. Как уже отмечалось, в опытах с лабораторным трубчатым реактором [32] была установлена противоположная закономерность.
Свое суждение о приближении режима полого реактора к модели идеального смешения с увеличением нагрузки мотивируют [39] тем, что доля газовой фазы и неравномерность ее распределения в реакторе, а также градиенты плотности газожидкостной смеси и скорости потоков возрастают, способствуя интенсивному продольному перемешиванию. В то же время из-за недостаточной эффективности поперечного перемешивания усиливается роль диффузионных факторов и уменьшается скорость образования карбамата аммония.
Для реакции дегидратации карбамата аммония, лимитирующей процесс синтеза карбамида и протекающей в основном объеме реактора, особо благоприятен режим вытеснения, так как примеси Н20 и CO(NH2)2 смещают равновесие реакции влево. Поэтому любое продольное смешение неизбежно приводит к снижению хь.
|
С
Рис. II.7. Статистические функции распределения времени пребывания индикатора в реакторе синтеза карбамида при различной нагрузке Vcoa> ма/ч (прн нормальных условиях): 1 — 4500; 2 — 4800; 3 — 5100. |
С учетом изложенного, считают [39], что в промышленных условиях смеситель и нижняя часть пустотелого реактора работают в режиме, близком к идеальному смешению. Причем степень смешения уменьшается по высоте реактора и режим работы приближается к идеальному вытеснению. Однако наличие некоторого количества газовой фазы (и после завершения процесса образования карбамата аммония), градиентов плотности газожидкостной смеси и скорости потоков в реакторе способствуют, видимо, осевому перемешиванию. Его интенсивность можно ориентиро - 72
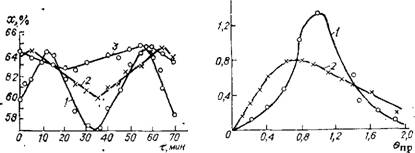
вочно оценить по частоте колебаний х во времени. С этой целью через определенные промежутки времени отбирали [39] пробы плава и определяли х на выходе. Результаты нанесены на график (рис. II.8). За начало отсчета времени (т = 0) во всех случаях принято время отбора первой пробы. Оказалось, что х колеблется от 57 до 64% (среднее значение 60,5%).
Известное средство уменьшения продольного перемешивания — секционирование аппарата установкой массообменных перегородок (тарелок) [38]. Исследования возможностей изменения гидродинамического режима за счет шеста ситчатых тарелок с живым сечением ~25% проводили [39] в промышленном реакторе объемом ~12 м3. Для количественной оценки изменения гидродинамики определены колебания значений х и выполнена индикация тарельчатого реактора.
Из рис. II.8 видно, что в реакторе с тарелками интервал колебаний х намного меньше, чем в реакторе без тарелок, и составляет 62,5—64,5% (среднее значение 63,3%). Повышение среднего значения х объясняют тем, что установка тарелок способствовала уменьшению градиентов скоростей потоков и концентраций в поперечном сечении реактора, интенсификации диспергирования газовой фазы и более равномерному распределению ее в газожидкостной смеси. В результате снизилась интенсивность продольного перемешивания, улучшился массообмен и поперечное смешение, ускорилось растворение газообразных NH3 и С02.
Статистические функции распределения индикатора в реакторе с тарелками и без тарелок показаны на рис. II.9. Для тарельчатого реактора кривая индикации, характеризующая степень перемешивания, имеет более высокий пик, что свидетельствует о приближении к гидродинамическому режиму идеального вытеснения [39].
|
С
Рис. II.8. Зависимость х от т с момента отбора первой пробы при различном числе тарелок в реакторе п: |
Вычислено [39], что для пустотелого реактора объемом 11,8 м3 критерий Ре»9. По сравнению с реактором объемом 31,5 м3, имеющим d = 1300 мм и h = 24000 мм
(-j - = 18,5) , у реактора
С объемом 11,8 м3 d = = 1060 мм, h = 14000 мм
= 13,2^. Из-за различий в соотношениях -^-имеет
Место различие в гидродинамических режимах: С-кривая для малого реактора более размыта, чем для большого при идентичной нагрузке [39]. Это означает, что в малом реакторе происходит более интенсивное продольное перемешивание. За счет установки тарелок критерий Ре увеличился до 26 единиц [39]. Следовательно, гидродинамический режим сместился в сторону идеального вытеснения, что открывает возможности значительного повышения эффективности, в частности, увеличения производительности.
Для экспериментальной проверки этого суждения реактор с тарелками и без тарелок поочередно подключали [39 ] к двум агрегатам дистилляции. В каждом случае нагрузку на реактор увеличивали до 190% по сравнению с проектной. Как видно из рис. 11.10, величина х в тарельчатом реакторе при нагрузке 125% от проектной выше, чем в обычном реакторе, на 3% (абс.). С ростом нагрузки до 155% величина х почти не снижается. Таким образом, промышленные испытания реактора с тарелками [39] показали возможность увеличения производительности реактора при одновременном повышении хв. Результаты исследований [39] свидетельствуют также о том, что за счет установки тарелок гидродинамический режим реактора можно приблизить к модели идеального вытеснения и при Р < 20 МПа.