Механизм полимеризации этилена на окиснохромовых катализаторах
|
161 |
Многие годы механизм действия окиснохромовых катализаторов был неясен. Эрих и Марк [171] предполагали катионный механизм, исходя из структуры полимера. Отличие окиснохромовых катализаторов от классических катализаторов Циглера— Нагта состоит в том, что они полимеризуют этилен в отсутствие активаторов, в частности АОС. При нанесении на алюмосиликат или силикагель хрома в количестве, отвечающем оптимальной активности катализатора, после активации были обнаружены соединения хрома, в которых хром имел различную степень окисленности: Сг6+, Сг5+, Сг3+, Сг2+. Неясным оставалось,
Какое из этих соединений является потенциальным АЦ,
Т. е. какова степень окисленности хрома в АЦ..
Ван Рейн и Косси [172] для полимеризации этилена на окиснохромовом катализаторе предложили ионно - координационный механизм, аналогичный механизму полимеризации на каталитической системе на основе ТіС13. Активной эти авторы считают связь Сг5+—С при октаэдрическом строении АЦ. Корреляция между содержанием ионов Сг5+- в катализаторе и его активностью была обнаружена также при изучении изменения общего содержания хрома в катализаторе и варьировании условий его активации [173], по изменению интенсивности сигнала ЭПР и активности катализатора при изменении продолжительности и температуры обработки катализатора растворителем [174], по появлению сигнала ЭПР во время индукционного периода и при активации катализатора в токе воздуха [175], при изучении механизма действия окиснохромовых катализаторов различными методами [176].
Другими авторами [177] при исследовании изменения состава катализатора, температуры активации и условий его обработки и восстановления была найдена корреляция между количеством иона Сг®+ и активностью катализатора.
В дальнейшем было показано [178], что при изучении спектров ЭПР катализатора при комнатной температуре, как это делалось в большинстве приведенных работ, ионы Сг5+ не полностью проявляются; например, на силикагеле и алюмосиликатах определение основного количества Сг5+ возможно только при температуре жидкого водорода.
Зависимость активности катализатора от наличия Сг[6]+ была подтверждена сотрудниками фирмы «Филлипс» [55]. Ими было показано, что в случае использования широкопористого носителя каждый агом хрома, находящийся на поверхности носителя, образует АЦ в том случае, если количество хрома в катализаторе всего 0,1%. В работе [179] сообщалось, что когда в катализаторе содержится 0,1% хрома, то примерно 95% хрома приходится на Сг6+.
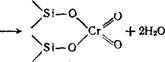
Хром в высшей степени окисления может находиться на поверхности носителя в виде силилхромата или си-
|
|
^Si—ОН
{ 4- HjCrO*
|
|
ОН
|
|
|
\ / \ / |
|
Si—О—or |
|
^О + ЗН20 |
' + 2HjCrO< —>
|
;Si—О—Сг |
Si—ОН
Si—ОН
О
Хоганом [179] по количеству выделившейся воды было показано, что образуется в основном хромат.
Таким образом, потенциальным АЦ является Сга+, однако для образования непосредственного центра роста полимерной молекулы с возможностью координации и встраивания мономера по связи Сг—С необходимо алкилировать и восстановить хром, однако предварительное восстановление хрома водородом до Сг3+ или Сг2+ полностью дезактивирует катализатор. Значит, для создания комплекса хрома (образования связи Сг—С в октаэдрической координации лигандов с вакансией для координации мономера) необходимо его восстановительное взаимодействие с этиленом или другим угле - родсодержащим восстановителем, например СО.
Хотя окиснохромовый катализатор является одно- компонентной системой (применяется без активатора), реакции роста предшествует взаимодействие с мономером или другим компонентом реакционной среды с образованием связи Сг—С [55]. Наличие индукционного периода, зависящего от температуры и давления, также свидетельствует о необходимости какого-то времени для образования АЦ:
I I
— Si—О л — Si—Оч
I \ сн2 ! \
О Сг +11 —> О ^Сг + 2НСНО (и другие
|
—Si—О |
|
—Si—О' |
|
6* |
|
163 |
| / СН2 I / продукты
Окисления этилена)
Если удалить летучие продукты реакции, катализатор приобретает голубой цвет (весь хром переходит в Сг2+). При полимеризации этилен в течение индукционного периода вытесняет продукты окисления, которые не образуют связи с хромом; остается активный комплекс, образованный продуктами восстановления хрома этиленом, со связью хром-углерод и вакансией для координации молекулы этилена и образования я-связи с хромом перед встраиванием в растущую полимерную цепь.
Точный механизм алкилирования хрома неизвестен. Если катализатор обработать окисью углерода при 300—500 °С, то Cr6f быстро переходит в Сг2+ без образования побочных продуктов.
Сг6+ + СО—»-Сг2+ + С02
После удаления С02 оранжевый цвет катализатора изменяется на голубой. Получается еще более активный катализатор, чем без обработки СО, и начало полимеризации сдвигается с 65 °С до —15 °С (даже —55 °С) без индукционного периода. Такие же результаты достигнуты предварительной обработкой катализатора этиленом при 150°С в условиях, когда полимеризация невозможна. ИК-спектрами было доказано наличие кар - боксилатного иона на поверхности окиснохромового катализатора, обработанного окисью углерода. Далее полимеризация идет по общей для ионно-координацион - ного механизма схеме [69]:
ЧС=С/ / \ ♦ I - ♦ - I
Lx—Me—R —► Lx—Me—С—С—R
Координация мономера осуществляется на вакантном месте у атома хрома с низкой степенью окисленности. На каждом АЦ образуется много тысяч полимерных молекул. При этом должен иметь место переное р-гид - рид-иона:
Lx—Ме[—СН,—СН2— ]„R —>• —► Lj—Me—Н + СН2=СН[—СН2—СН2—]„-,R
Увеличение температуры сильно ускоряет эту реакцию
И молекулярная масса, как уже отмечалось, резко уменьшается. Исследование структуры макромолекул ПЭ подтверждает такой механизм роста и обрыва полимерных цепей: на одном конце макромолекулы находится метильная, а на другом—винильная группа.