Первые представления о механизме действия циглеровских катализаторов при полимеризации олефинов
Многообразие гипотез о механизме действия циглеровских катализаторов связано прежде всего с многообразием каталитических систем, используемых различными авторами для исследования полимеризации олефинов.
Катализаторы Циглера — Натта получаются при взаимодействии двух или нескольких компонентов, каждый из которых относится к различным классам химических соединений. В качестве основного компонента применяются соединения элементов IV—VI групп (в последнее время и VIII группы), в качестве активатора—■ алкилы, алкилхлориды и алкилгидриды элементов I—III групп периодической системы. Кроме АОС, Циг - лером запатентованы магний-, цинк - и натрийорганиче - ские соединения, металлорганические комплексные соединения этих металлов и в дальнейшем алкоксиды этих металлов. Таким образом, в качестве активаторов используются все металлорганические соединения элементов I—III групп периодической системы элементов, которые содержат, по меньшей мере, одну связь металл - углерод на молекулу.
По данным Натта, в качестве основного компонента циглеровских катализаторов особенно пригодны такие соединения переходных металлов, которые обладают низким первым потенциалом ионизации (галогениды, алкоксиды, галогенэфиры или соединения с органическим комплексообразователем, например, ацетилаце - тонаты).
Оба компонента катализатора очень реакционноспо - собны. Они взаимодействуют с множеством соединений (аминами, меркаптанами, эфирами, спиртами, окислами и т. д.). Это создает основу для их модификации, хотя и сопряжено с трудностями при их изучении.
. Из переходных металлов чаще всего используется титан. Применяют как хлорид титана в восстановленной форме. ТіС13 (и тогда сокатализатор является активатором), так и ТіСЦ (тогда сокатализатор действует как восстановитель и как активатор). Реакции, протекающие во втором случае [144]:
А1(С2Н5)з + ТІСІ4 —>, С1А1(С2Н5)2 + ТіС1з(С2Н5) . 2А1(С2Н5)з + ТІСІ4 —> 2С1АІ(С2Н5Ь + ТіСІ2(С2Н5)2
Образовавшиеся алкилтитанхлориды неустойчивы и разлагаются с образованием газообразных продуктов [145]:
,—^ 2ТіС1з + С2Н4 + С2Н6
2ТІС13С2Н5 —
2TiCj2 + 2С2Н5СІ
Наиболее стабильные промежуточные соединения — метилтитантрихлорид и диметилтитандихлорид—были выделены. Образование этана, этилена и этилхлорида в этих реакциях также было доказано экспериментально.
Если в качестве сокатализатора использовать гало - генид алкилалюминия, то он реагирует медленнее с соединением титана и даже из ТіСЦ не может восстановить титан до Ті2+, а образует только TiCU:
С1А1(С2Н5)2 + ТІСІ4 —> ТІСіз + С12А1(С2Н5) + С2Н5.
СІ2АІ(С2Н5) + ТіСЦ —^ ТІСІЗ +АІСІз + С2Н5*
В зависимости от условий получения катализатора образуется алюминийгалогенид или алюминийалкилга - логенид, а частицы катализатора могут получаться разной формы и размеров, разной пористой структуры и склонности к агломерации. Даже разбавитель (его вязкость и т. д.) влияет на свойства и активность катализатора, а также на свойства получаемого полимера (насыпная плотность порошка и т. д.).
В первые годы на исследователей механизма полимеризации на этих катализаторах оказала влияние работа Циглера [146] о получении длинноцепных алюми - нийорганических соединений из этилена и триалкил - алюминия:
R2A1—R + СНг=СН2 —» R2AI—СІІ2—СН2—R
Если реакция протекала при повышенной температуре (порядка 100°С), то происходил быстрый обрыв переносом водорода на катализатор с образованием гидрида алюминия:
R2Al—CHj— СН2—R —* RjAlH + СН2=СН—R R2A1H + СН2=СН2 —>- R2A1CHsCH3
Поэтому сложилось представление, что при добавке к АЦСгНй)^ соединений титана на поверхности ТіС13 протекает полимеризация адсорбированного и активированного мономера по типу получения длииноцепных АОС, но в этой реакции скорость роста уже много выше скорости переноса гидрид-иона, поэтому получаются высокомолекулярные продукты. Такое представление подтверждалось обнаружением в полимере фенильных групп при использовании в качестве сокатализатора трифенилалюминия (что впоследствии послужило основой для объяснения переноса цепи на алюминий - алкилы).
Для объяснения действия циглеровских катализаторов разные авторы привлекали различные механизмы полимеризации:
1) радикальный с участием свободного радикала
~СН2— CHR:
2) катионный ~СН2—CHR + CH2 = CHR;
3) анионный ~СН2—CHR + CH2 = CHR.
Для объяснения структуры и состава катализатора в переходном состоянии Ульцман [147] предложил ионный механизм, согласно которому АЦ имеет вид:
[TiCl3]+[AlR3Cir
Катионный механизм циглеровской полимеризации с самого начала был отвергнут, так как на катализаторах катионного типа из этилена и пропилена образовались бы низкомолекулярные разветвленные продукты, а не высокомолекулярный ПЭ и не стереорегуляр - ный ПП. !
Следующее предположение было об анионном механизме (по типу получения Циглером длииноцепных ме-
Ме+—С" Ме++С"
Nu— R Al+—R" Nu
СН2=СН2 CH2-=CHJ сн2—CH2R
Этот механизм подтверждался тем, что по мере увеличения длины цепи увеличивается плотность электронов у двойной связи и скорость полимеризации должна падать, что и обнаруживалось в экспериментах, т. е. СН2 = СН—R полимеризуется хуже, чем СН2 = СН2 (в дальнейшем это явление было объяснено увеличением стерических затруднений при встраивании мономера с ростом длины цепи).
Однако этому предположению противоречил тот факт, что на типично анионных катализаторах (например, алкилах щелочных металлов) полимеризация мо - ноолефинов не происходит.
Некоторые авторы считают, что в каталитической системе, содержащей Ti4+, во время его восстановления при гемолитическом распаде неустойчивых титанорга - нических соединений возникают свободные радикалы или ион-радикалы, которые инициируют полимеризацию олефинов. Адсорбированный алкильный радикал в ходе реакции роста движется вдоль поверхности и присоединяет адсорбированные молекулы мономера, причем, будучи «локализованными» на поверхности, эти радикалы не подвергаются столь быстрой гибели за счет бимолекулярного обрыва, как свободные радикалы.
Концепция радикального механизма также была подвергнута серьезной критике после изучения кинетики полимеризации на циглеровских катализаторах по следующим причинам:
1) скорость полимеризации и молекулярная масса не снижаются при введении в реакционную зону типичных - ингибиторов радикальной полимеризации;
2) каталитическая система ТіСІз — А1(С2Н5)2С1 вызывает полимеризацию этилена, но не образует свободных радикалов в условиях проведения процесса;
3) в синтезированных полимерах имеются конечные винилиденовые группы', которых не было бы в радикальном процессе;
4) полярный эффект заместителей ряда виниларома - тических мономеров при полимеризации на катализаторах „Циглера—Натта проявляется противоположно по сравнению с радикальной полимеризацией [21, 148];
5) энергия активации процесса полимеризации по радикальному механизму составляет 100,8— 117,6 кДж/моль, для циглеровской полимеризации — 42—50,4 кДж/моль.
Натта предложил анионно-координационный механизм циглеровского катализа. Он представил АЦ как биметаллический комплекс с мостичными связями:
|
Ті |
|
\ |
|
/ |
>А1:
Такие комплексы выделены и мостичные связи доказаны. Титан, имея положительный заряд, поляризует группу СЩ. Скоординированный олефин активируется и встраивается по связи Ті+—-СНг, а конец растущей макромолекулы остается отрицательно заряженным (анион).
Позднее утвердилось мнение, что определяющим компонентом в каталитическом комплексе циглеровских катализаторов является соединение переходного металла. Дьячковский методом ЯМР подтвердил [149], что рост полимерной цепи происходит по связи Ті—С. В спектрах ЯМР катализаторов Циглера происходит расщепление структур на структуру, обусловленную связями Ті—С и А1—С; если ввести мономер, который не полимеризуется, а только встраивается (например, ви- нилацетилен), то исчезают линии, соответствующие связи Ті—С. Работы Бура [150] и Оливе [151] также подтверждают это мнение. Имеются даже катализаторы (ТіСЬ, VCI2, ацетилацетонат титана и др.), которые работают без алкилов А1.
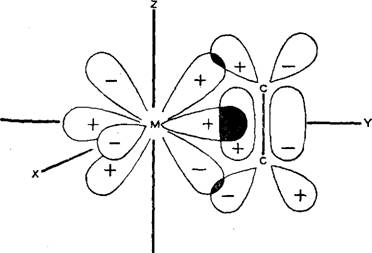
В настоящее время после выделения комплекса Pt и Pd с этиленом стало возможным предположить, что каждому акту присоединения мономера предшествует образование я-комплекса молекулы олефина с атомом переходного металла, в этом комплексе двойная связь
Мономера выполняет функцию донора, а атом переходного металла, благодаря незаполненности d-электрон- ного уровня, — акцептора электронов (рис. 5.1).
Изучение структуры комплексов переходных металлов с олефинами показало, что в комплексах, где при координации мономера растяжение связи С = С велико, дативная компонента связи металл-олефин играет большую роль, чем донорно-акцепторная [152]. В а-связи электронная плотность переходит от олефина к металлу и, напротив, посредством я-связи удается осуществить переход электронной плотности от металла на активированную орбиталь олефина. В результате двойная связь олефина дестабилизируется и расстояние между обоими углеродными атомами увеличивается, что равносильно активации молекулы.
Таким образом, молекулы мономера, взаимодействуя с каталитическим комплексом, сначала образуют координационную связь с металлом переменной валентности соответствующей ориентации. Отсюда название
|
Рис. 6.1. Модель Дьюара — Шатта — Дункансона.
|
Механизма, предложенное Ната, — «анионно-координаци - онный». Координация мономера повторяется в каждом акте присоединения мономера. Возникновение я-ком - плекса приводит к ослаблению мостичной связи Me R, что облегчает внедрение мономера.