Влияние строения алкилалюминиевого компонента каталитического комплекса на полимеризацию этилена
Как было сказано выше, в первых промышленных каталитических системах в качестве алкилалюминиевого компонента каталитического комплекса использовали А1(СгН5)2С1 или А1(С2Н5)з. Это объяснялось простотой синтеза этих соединений и сравнительной доступностью исходного сырья для их получения.
Однако в дальнейшем было выявлено, что алюминий - алкилы обладают далеко не одинаковой химической активностью в составе каталитического комплекса. Так, еще Циглер указывал, что наивысшая реакционная способность наблюдается у триалкил - или гидридалкилалю - миния. При наличии у алюминия других заместителей (например, галогенов) реакционная способность значительно уменьшается.
Систематическому изучению влияния состава и строения алкилалюминиевого компонента на процессы полимеризации и сополимеризации этилена посвящены работы [17, 24, 74]. Изучались АОС с различными алкиль - ными группами, что позволило исследовать влияние заместителей с разными электроноакцепторными характеристиками, а также с различной способностью вызывать стерические препятствия для подхода нуклеофиль - ных агентов. Показано, что активность каталитических комплексов, содержащих алюминийтриалкилы нормального строения, в процессе полимеризации этилена падает с увеличением длины алкила (температура полимеризации 60 °С, давление 0,3 МПа, растворитель гексан):
Alk в А1(А1к)з С2Н5 С3Н7 С4Н„ С8Н17 С9Н19 Cls_17H3l_35
Скорость полимеризации, 1450 1210 1140 740 670 Следы
Г/(г Ті-ч)
[ЛІ (декалии, 135 °С), 5,5 3,0 4,5' 2,5 2,0 —
Дл/г
Степень восстановления 83- 85 76 - 78 77- 79 58- 60 55- 58 0 Ті, %
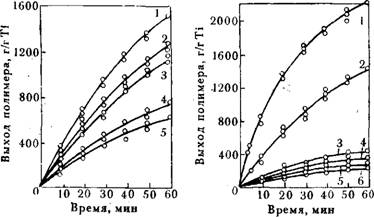
По-видимому, снижение активности катализатора с увеличением длины алкила в АОС (рис. 2.2) обусловлено стерическими факторами.
С увеличением длины алкила уменьшается количество титана, восстанавливаемого при взаимодействии ТІСЦ с АОС. Так как скорость алкилирования должна снижаться при переходе от низших к высшим членам ряда алюминийтриалкилов нормального строения, а скорость восстановления Ті4+ увеличиваться благодаря реакции элиминирования [75], то указанный эффект отражает превалирующее значение стадии алкилирования.
С понижением активности каталитического комплекса уменьшается также молекулярная масса полимеров. По-видимому, это объясняется увеличением значения ограничения полимерной цепи за счет переноса гидрид - иона от (З-углеродного атома растущей цепи к комплексу [18; 21, с. 206] с ростом числа углеродных атомов в алкильных группах.
Результаты исследования сравнительной активности монозамещенных АОС А1(С2Н5)2Х показаны на рис. 2.3 и ниже:
АОС AIEt3 AIEtoH AIEt2CI AIEt2OC2H5 AIEt2NEt2
Скорость полнмери - 1450 2150 370 200 Следы зации, г/(г Ті'Ч)
И (декалии, 135 °С), 5,5 2,65 1,0 0,85 — Дл/г
Степень восстано - 83- 85 98-100 48- 50 22- 25 — влення Ті, %
Резкое снижение активности комплекса при замене одного алкила в А1(С2Н5)3 на хлор, вероятно, связано с повышением электроноакцепторных свойств этого АОС. В еще большей мере этот эффект проявляется в дизамещенном этилалюминийдихлориде, скорость полимеризации в присутствии которого ничтожно мала. Замена одной этильной группы в А1(СгН5)3 на водород увеличивает электронодонорные свойства АОС. Соответственно повышается активность в полимеризации каталитического комплекса с этим соединением. По-видимому, связь Ті—С в этом комплексе обладает оптимальной лабильностью.
Активность комплексов с диэтилалюминийгалогени - дами изменяется в следующем ряду:
А1(С2Н5)2С1 > А1(С2Н5)2Вг > А1(С2Н5)21
Низкую активность комплексов на основе А1(С2Н5)2І можно объяснить стерическими затруднениями, создаваемыми большим по объему атомом иода. Этот фактор оказывается здесь более важным, чем электроотрицательность, так как во втором случае активность этих соединений должна была бы изменяться в обратном порядке.
Введение алкоксигруппы ОС2Н5 вместо этилыюй в А1(С2Н5)з приводит к резкому снижению активности комплексов, что, возможно, связано с образованием прочного, относительно устойчивого к нуклеофильной атаке титана димера:
ОС2Н5 Н5С2Оч Д"5 /ОС2Н5
(СаНзЬАҐ ;АІ(С2Н5)2 ;АГ чАГ
Ос2н5 Сі Чс'н*
Еще более стабилен ассоциат диэтилалюминийди - этиламина, вследствие чего каталитический комплекс на его основе обладает низкой активностью при полимеризации этилена.
Таким образом, по активности в процессе полимеризации комплексы на основе триэтилалюминия и его мо - нозамещенных производных располагаются в следующий ряд:
А1(С2Н5)2Н > А1(С2Н5)з > А1(С2Н5)2С1 > А1(С2Н5)2ВГ > > A1(C2H5)2I > А1(ОС2Н5) (С2Н5)2 > AI(C2H5)2N(C2H5)2
Активность монозамещенных производных триизобу - тилалюминия изменяется следующим образом:
АІ(«зо-С4Н9)2Н > А1(«ЗО-С4Н9)з > АІ(«ЗО-С4Н9)2СІ > > (С2Н5—СН=СН)А1(«зо-С4Н9)2 > («зо-С4Н9)2А1(ОС4Н9-изо)
Относительно высокая активность каталитического комплекса наблюдается и при введении в алкилалюми - ний в качестве заместителя группы с ненасыщенной
Рис. 2.2. Влияние длины алкила на зависимость выхода полимера от времени полимеризации этилена на каталитических комплексах с различными алю - мииийтриалкилами:
С2Н5; г-с3н7; 3-С4Н9; 4-CsHi7; 5—CgHig.
|
Рис. 2.3. Влияние АОС на зависимость выхода полимера от времени полимеризации этилена при 60 °С и коицеитрацни этилена 0,116 моль/л: І-АІ(С2Н5)2Н; 2-АІ(С2Н5)з; 3-АЦС2Н5)2С1; 4-AI(C2H0)2Br; 5—А1(С2Н5)2Г; 6-А1(ОС2Н5)2Н.
3 Зак. 657 65 |
Связью: СН2=СН—СН2—СН3. В этом случае акцепторные свойства проявляются, видимо, меньше.
Замена изобутильной группы в триизобутилалюми - нии на более электроотрицательную группу — галоген приводит к меньшему снижению скорости реакции, чем у этильных производных. По-видимому, в данном случае превалирует стерический фактор.
Помимо перечисленных факторов, активность каталитического комплекса зависит также от энергии связи А1—С. Различную реакционную способность связей А1—С в алюминийтриалкилах наблюдал Гавриленко при последовательном карбоксилировании, галогенировании, сульфировании и селенировании алюминийтриалкилов [76].
Количественная оценка реакционной способности связи А1—С алюминийалкилов проведена в работах Кор - неева [77] и Сахаровской [78]. На примерах термического разложения, окисления и взаимодействия с амино - - и гидроксилсодержащими соединениями авторами изучены свойства ряда алюминийалкилов нормального и изомерного строения. Показано, что при нагревании АОС скорость термической диссоциации алюминийтриалкилов снижается с удлинением алкильной группы, а для соединений R2A1X, где X—NR2, A10R2, OR, Н, F, CI изменяется в следующем порядке:
NR2 > AlORs > OR > Н > С!
Активность АОС в реакции окисления изменяется обратно изменению их термической стабильности. Аналогичные закономерности были выявлены и в реакциях взаимодействия алюминийалкилов с амино - и гидроксилсодержащими соединениями.
Реакционная способность алюминийалкилов по отношению к спиртам понижается в ряду [77]:
А1(СзН7)з > А1(С2Н5)з > А1(нзо-С4Н9)3 > А1(С2Н5)2С1 > > А1(«зо-С4Н9)2(ОС4Н9-«зо)