ПЕРЕРАБОТКА ЛОПАРИТОВЫХ КОНЦЕНТРАТОВ
Лопарит - сложное комплексное сырье. Концентраты содержат, % (по массе): (Nb, Ta)2os 8-9; (при отношении Nb2Os: Ta2Oj « 15:і), ТЮ2 32 - 35; (Ce, La...)203 26 28; СаО 6-8; Na2o 7 - 8, в подчиненных количествах К2о, SrO, ОКСИДЫ Fe И А1, а также ТЮ2 0,2 - 0,7.
Среди редкоземельных элементов в лопарите представлена цериевая группа, причем преобладает содержание оксидов церия и лантана.
Технология должна обеспечивать извлечение всех ценных составляющих: ниобия, тантала, редкоземельных металлов и титана. Разработаны и используются две технологические схемы переработки лопаритовых концентратов - хлорная и сернокислотная.
Способ хлорирования
Все ценные составляющие лопарита наиболее просто можно извлечь способом хлорирования. Сущность его состоит в том, что компоненты рудного концентрата взаимодействуют с газообразным хлором при 750 - 850 °С в присутствии угля или кокса. Различия в летучести образующихся хлоридов позволяют разделить основные ценные составляющие концентрата.
Ниже приведены температуры плавления и кипения некоторых хлоридов:
Хлорид NbCl, NbOClj А1С13 ТаС15 ТІСІ,
<ПЛ,°С .... 204,7 - - 216,5 -23
'кип - °С • . .
Хлорид FeClj
<пл.°£ ■ • • 'кип> С. . .
Хлориды ниобия, тантала и титана, имеющие сравнительно низкие точки кипения, в процессе хлорирования уносятся с газами и улавливаются в конденсационных устройствах; вы - сококипящие хлориды редкоземельных металлов, натрия и кальция остаются в хлораторе в форме плава хлоридов.
Ниже приведены реакции хлорирования основных ценных составляющих лопарита[4]:
Nb2Os + ЗС12 + 1,5С = 2NbOCl3 + 1,5С02 ; (2.3)
Nb2Os + 5С12 + 2,5С = 2NbCls + 2,5С02 ; (2.4)
Ta2Os + 2С12 + 2,5С = 2TaCls + 2,5С02 ; (2.5)
ТЮ2 + 2С12 + С = ТіС14 + С02 ; (2.6)
(Ln)203 + ЗС12 + 1,5С = 2(Ln)Cl3 + 1,5С02 . (2.7)
Одновременно С02 реагирует с углеродом с образованием
Со:
С02 + с 2СО. (2.8)
Хлорирование оксидов происходит также с участием оксида углерода, например, по реакциям:
Nb2Os + ЗСО + ЗС12 = 2NbOCl3 + ЗС02 ; (2.9)
ТІ02 + 2СО + 2С12 = ТіС14 + 2С02 . (2.10)
Другие образующиеся при хлорировании хлориды: СаС12, NaCl, А1С13, FeCl3, SiCl4 .
Реакция хлорирования (2.3) - (2.7) протекают со значительной убылью энергии Гиббса и практически необратимы.
|
248,3 |
~400 |
180 |
234 |
136 |
|
|
(субл.) |
(субл.) |
||||
|
FeCl3 |
SiCl4 |
СеС13 |
LaClj |
СаС12 |
NaCl |
|
304 |
-67 |
800 |
850 |
782 |
800 |
|
319 |
58 |
1730 |
1750 |
2027 |
1465 |
Роль углерода состоит не только в связывании кислорода в С02, но также в активировании процесса хлорирования (см. гл.4).
Хлорирование лопаритового концентрата можно проводить В хлораторах шахтного типа с брикетированной шихтой или в
Хлораторах с солевым расплавом. Последние имеют существенные преимущества: исключаются трудоемкие операции приготовления брикетов и их прокаливания; благодаря эффективному массо - и теплообмену в перемешиваемом барботирую - щим хлором расплаве обеспечивается высокая скорость процесса и, соответственно, высокая удельная производительность хлоратора.
При хлорировании лопаритового концентрата расплавленная ванна создается образующимися высококипящими хлоридами натрия, калия, кальция и редкоземельных элементов.
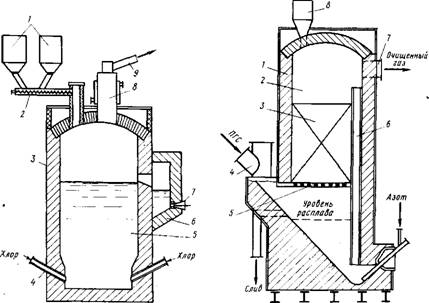
Рис. 24. Хлоратор для хлорирования лопаритового концентрата в солевом
Расплаве:
1 - бункеры для концентрата и кокса; 2 - шнековый питатель; 3 - хлоратор, футерованный шамотным кирпичом; 4 - фурмы; 5 - расплав; 6 - копильник; 7 - летка; 8 - охлаждаемый газоход; 9 - патрубок вывода ПГС в систему конденсации
Ркс. 25. Схема солевого фильтра с аэролифтной циркуляцией расплава: 1 - корпус, футерованный шамотным кирпичом; 2 - каплеуловительная камера; 3 - инертная керамическая насадка; 4 - газоход; 5 - колосниковая решетка; 6 - аэролифтная труба; 7 - патрубок вывода ПГС; 8 - загрузочный бункер кусков NaCl
4-1325
Примерный состав такого расплава, % LnCi3 55; СаС12 20; NaCl 15, остальное - хлориды других элементов. Температура затвердевания расплава 520 °С. Тонкоизмельченный концентрат и нефтяной кокс подаются в расплав хлоридов, через который барботируют хлор, поступающий через фурмы в нижнюю часть хлоратора.
Хлоратор представляет собой шахту прямоугольного сечения с высотой уровня расплава 3,1 - 3,2 м (рис.24). По мере хлорирования избыточный расплав непрерывно сливается через переточный канал в копильник. Нагревается расплав с помощью графитовых электродов, смонтированных в стенки хлоратора.
Хлорирование ведут при 850 - 900 °С, среднем содержании концентрата в расплаве 1,5 % и углерода ~5 %. В этих условиях удельная производительность хлоратора по концентрату - 5 -5,5 т/м2 сечения печи в 1 сут.
Особенностью хлорирования в расплаве является преобладание содержания со2 над со в газовой фазе (отношение со2:со « 16:1). Из этого следует, что реакции хлорирования оксидов в оасплаве идут с образованием со2, а реакция Будуара (со2 + с<—-2СО) протекает лишь частично, так как пузырьки со2 быстро удаляются из расплава, не успевая вступить в реакцию с взвешенными частицами кокса.
Испытывали различные системы конденсации компонентов парогазовой смеси (ПГС). Получила распространение система, в которой последовательно осуществляется первоначально конденсация твердых хлоридов (NbOCi3, NbCis, TaCls и др.) в пылевых камерах при температурах на выходе из камер 200 - 140 °С, а затем жидких хлоридов (TiCi4, SiCi4) в оросительных конденсаторах с орошением охлажденным тет - рахлоридом титана.
С целью отделения хлоридов железа и алюминия и исключения их конденсации вместе с хлоридами ниобия и тантала перед пылевыми камерами устанавливают солевой фильтр. Его действие основано на образовании FeCi3 и Aici3 с хлоридами натрия и калия легкоплавких комплексов типа MeFeCi4 и МеА1С14, термически устойчивых и обладающих низким давлением паров рпар при температурах 500 - 600 °С:
KA1C14 NaAlCl4 KFeCl4 NaFeCl4
Гпл, °С 256 152 249 163
Рпар ПРИ 500 °С,
Па 20 13,3 36,3 334
98
Над солевыми расплавами систем Naa-Fea3-Aici3 и Kci-Feci3-Aici3 давление паров хлоридов NbOCi3, NbCis, TaCls, TiCi4, SiQ4, высокое, поэтому они не поглощаются расплавами солевого фильтра.
На рис.25 приведена схема солевого фильтра. Расплав хлоридов в фильтре циркулирует с помощью аэролифтного устройства.
В фильтр периодически загружают смесь NaCl + КС1 или отработанный электролит магниевых электролизеров. По мере накопления из фильтра сливается расплав, насыщенный хлоридами железа и алюминия.
В солевом фильтре помимо хлоридов железа и алюминия улавливаются твердые частицы (механический унос из хлоратора).
Конденсат твердых хлоридов имеет следующий примерный состав в пересчете на оксиды, % (по массе): (Nb, Ta)2os 51 - 54; ТЮ2 1,0 - 1,8; Fe203 0,40 - 1,4; Si02 0,43 - 1,4; ai2o3 0,64 - 0,8; Tho2 ~0,1; Ln2o3 0,9; с 0,5 - 2. Часть тантала и ниобия попадает в конденсат жидкого TiCl4, где они находятся в растворе и частично в виде взвеси. При ректификационной очистке TiCl4 они остаются в кубовом остатке, из которого дополнительно извлекаются.
Таким образом, в результате хлорирования лопарита получают три продукта: плав, содержащий хлориды РЗМ, конденсат хлоридов тантала и ниобия и технический тетрахло - рид титана.
Для получения смеси оксидов тантала и ниобия конденсат хлоридов подвергают гидролитическому разложению:
2NbOCl3 + О + 3)Н20 = NbjOj • хН2о + 6НС1; (2.11)
2TaCls + (х + 5)Н20 = Ta20s'xH20 + 10НС1. (2.12)
В кислый раствор переходит большая часть примесей железа, алюминия и частично титана. Полученная смесь гидро - ксидов, содержащая до 90 % (Nb, Ta)2os (в прокаленном продукте), поступает на очистку и разделение тантала и ниобия. Другой путь переработки конденсата, содержащего NbOCi3, NbCls, TaCis, хлориды железа, алюминия и др., заключается В получении смеси ЧИСТЫХ пентахлоридов NbClj и ТаС15, которые затем можно разделить методом ректификации.
Хлорная технология переработки лопарита обеспечивает извлечение 93 - 94 % ниобия и 86 - 88 % тантала в технические оксиды, 96,5 - 97 % титана в технический тетрахло - рид, извлечение 95,5 - 96 % редкоземельных металлов в плав хлоридов.
Сернокислотный способ
Сернокислотный способ основан на разложении лопарито - вого концентрата серной кислотой и разделении ценных составляющих с использованием различий в растворимости двойных сульфатов титана, ниобия и тантала, редкоземельных элементов с сульфатами щелочных металлов или аммония.
Концентрат разлагают (сульфатизируют) 95 %-ной серной кислотой при 150 - 250 °С. Расход кислоты - 2,78 т на 1 т тонкоизмельченного концентрата. Добавление сульфата аммония (0,2 т на 1 т концентрата) к серной кислоте предотвращает спекание реагирующей массы и повышает извлечение в раствор ниобия и тантала. Полное разложение концентрата достигается за 20 - 30 мин. К концу разложения получают полусухую массу. Основные реакции, протекающие при разложении:
Тю2 + СаО + 3H2so4 = CaTi(so4)3 + зн2о; (2.13)
4ТЮ2 + Ln2Oj + 11H2S04 = Ln2(S04) X
X 4Ti(S04)2 + 11H20. (2.14)
Ниобий и тантал в присутствии больших количеств титана входят в состав двойных сульфатов титана в виде изоморфной примеси. Продукт сульфатизации выщелачивают водой. В твердой фазе остается подавляющая часть РЗЭ в форме малорастворимых двойных сульфатов Na2so4 • Ln2(so4)3 • 2Н2о и их изоморфной смеси с CaS04. В раствор переходят титан (в виде Ti0S04), ниобий и тантал (вероятно, в форме сульфатов 32o3(so4)2.
Для отделения титана от ниобия и тантала используют осаждение сульфатом аммония малорастворимой двойной соли (NH^TicKso^j • н2о. При суммарной концентрации H2so4 + + (NH4)2so4 400-600 г/л растворимость соли равна 2,5- 5г/л. В осадок выделяется 70 - 80% титана от его содержания в растворе. Двойной сульфат титана используют как эффективный дубитель кожи. Термическим его разложением можно получить технический диоксид титана.
Из раствора, в котором остаются ниобий, тантал и часть титана, извлекают ниобий и тантал экстракцией (см. ниже).
Сернокислотный способ не обеспечивает столь четкого разделения всех ценных составляющих лопарита, какое достигается при хлорировании. Однако положительной его стороной является использование дешевого реагента и лучшие санитарные условия труда.
Извлечение ниобия, тантала и РЗМ в конечные продукты примерно такое же, как в хлорном спосббе, извлечение титана ниже (~70 %). Его можно повысить дополнительным извлечением титана из рафинатов после экстракционного извлечения ниобия и тантала.