ХЕМИ0СМ0ТИЧЕСК0Е СОПРЯЖЕНИЕ
Механизм фосфорилирования в окислительно-восстановительной цепи до сих пор нельзя считать точно установленным. Важное значение для его исследования имеет теория хемиосмотиче - ского сопряжения, развитая Митчеллом. Эта теория была предложена впервые в 1961 г. [41]. Ее подробное изложение содержится в обзорных работах Митчелла [42—45] и в монографии Скулачева [46].
Не пользуясь непосредственно представлениями неравновесной термодинамики, Митчелл оперирует понятием сопряжения, необходимым при рассмотрении открытых систем. Очевидно, что сопряженные процессы универсальны в живой природе. В любой биохимической реакции, катализируемой ферментом, имеется
Сопряжение между электронными и конформационными перестройками. В системе, содержащей жидкие фазы, разделенные мембраной, возникает сопряжение между химическими реакциями и мембранным транспортом, именуемое Митчеллом хемиосмотическим сопряжением. Мембрана играет роль сопрягающей системы. В столь общей формулировке идея хемиосмотического сопряжения не содержит чего - либо нового по сравнению с представлениями об активном мембранном транспорте, изложенными в гл. 2 и 3. Особенности подхода Митчелла состоят в следующем.
Предлагается конкретная модель сопряжения дыхания с фосфорилированием, исходящая из феноменологических соображений.
Рассматриваются главным образом равновесные соотношения между факторами, определяющими сопряжение.
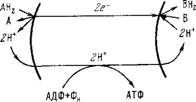
Рис. 6.12. Принцип хемиосмотического сопряжения окисления и фосфорилирования по Митчеллу. і — внутренняя, е — внешняя стороны мембраны.
Конкретная модель представляется схемой, показанной иа рис. 6.12 [46]. Донор водорода АН2 (например, аскорбат) окисляется ^переносчиком электронов (например, цитохромом с) у внешней стороны мембраны. Два электрона переносятся через
мембрану по дыхательной цепи и посредством цитохромоксидазы передаются акцептору водорода В, т. е. кислороду. Акцептор присоединяет два протона из внутренней фазы митохондриаль - ного матрикеа. Создается градиент концентрации протонов — их избыток во внешней и недостаток во внутренней жидкой фазе. Вследствие этого происходит перенос протонов через мембрану в противоположном направлении, в результате чего и реализуется фосфорилирование — синтез одной молекулы АТФ приводит к поглощению двух протонов из внешней фазы и выделению двух протонов в матрикс. Митохондриальная мембрана работает как топливный элемент, в котором разность электрохимических потенциалов создается за счет окислительно-восстановительного процесса.
Равновесные термодинамические соотношения определяются тем, что разность свободных энергий в системе слагается из химической и осмотической (транспортной) работы:
АО = ДОхим + АСосм, (6.16)
Где
Д«о;м = I V/(M7 - И?) + X v; - ц°). (6.17)
Сумма по / есть сумма по всем продуктам, сумма по і—по всем реагентам. ц® — стандартные химические потенциалы, vj, V,- — соответствующие числа молей. Если переносится лишь один компонент, то обобщенная сила, действующая на него, есть
ДІЇ = - ДСосм/v. (6.18)
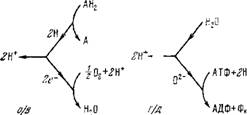
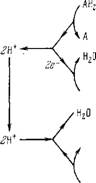
Схему, показанную на рис. 6.13, можно считать состоящей из двух «петель» (рис. 6.13, а) — окислительно-восстановительной (дыхание, о/в-петля) и гидрогенизационно-дегидрогенизацион - ной (дефосфорилирование, г/д-петля). Сопряжение обоих процессов посредством протонного транспорта показано на рис. 6.13,6. Согласно (6.17) имеем в равновесии
Д(ін+ = - Д0осм/2 = ^Дф, (6.19)
Где SF — число Фарадея, Дг|з — разность потенциалов (в вольтах). В процессах о/в и г/д
- (А«оем)о/в = - (А«осм)г/д = 2 ДДн (6.20)
И в сопряженной системе
ДОосы = - (А«осм)о/в 4 (А«осм)г/д. (6.21)
Полный электрохимический потенциал каждого компонента в системе выражается формулой
<0
Где р — давление, — молярный объем, zt — заряд компонента, — электрический потенциал, с, — концентрация (активность).
JOi + Ztt*
АТФ+<?Н+
АДФ + Ф„
Рис. 6.13. Детализация схеїмьі Митчелла.
А — петли о/в и г/д; 6 — сопряжение обоих процессов.
Полная обобщенная сила, приводящая к равновесию 1-го компонента во внешней фазе и в матриксе, равна
Д(хг = Уг Ap + zt&~ &i> + RTA\nCi, (6.23)
Причем можно показать, что член VtAp относительно мал. Для протонов
ДДН = Л\|з + RTA In сн+, (6.24)
Или, переходя к рН,
Д(хн = ^"Аф —2,3/?ГДрН. (6.25)
Протонодвижущая сила
Д/^Дф —ZApH (6.26)
(6.27)
Состоит, таким образом, из двух вкладов (Z = 2,3 RT/&~). При равновесии между внешней (е) и внутренней (і) фазами Д£ч = 0 и пз (6.23) следует
, с? Aib = In-*-,
С
Т. е. уже известная формула для равновесия Доннана — Нернста (см. стр. 123).
С перемещением протонов через мембрану связано определенное значение ее энергетической емкости, т. е. буферного действия. Емкости фаз е и і равны
_ dH+ dHf
Где сШ+ означает число протонов, добавляющихся в соответствующую фазу. Буферная емкость мембраны В определяется числом протонов ДН+, переходящих из фазы е в фазу і на единицу понижения рНе по отношению к рН,, или
L/B=l/Be+l/Bt.
ЛН+ = — В АрН. (6.30)
Аналогичным образом, электрическая емкость сопрягающей мембраны равна
С-
Где Де+ есть число положительных зарядов, переносимых из фазы е в фазу і. При С = const
Ае+ = С Лг|х (6.32)
Работа, совершаемая при генерировании разности рН обратимым переносом протонов, равна
-АрН
ГДрн= \ ZApHrf(AH), (6.33)
-АрН»
Где Д рН° — равновесное значение А рН и Д рН' = А рН — А рН°. При постоянной буферной емкости В
Гдрн< = '/2 ZB {(АрН)2 - (АрН0)2}. (6.34)
Аналогичным образом получаем выражение для работы, совершаемой при генерировании A\f> обратимым переносом протонов
Гдг = 72С{(Аф)2-(Дг|э0)2}. (6.35)
Причем
Если В = const, то
Если установлено равновесие для протонов, то протонодвижу- щая сила А/= 0 (ср. (6.26)), Дф° = £ДрН° и полная энергия
WAf хемиосмотической системы, связанная с электрическим и химическим компонентами этой силы, равна
Wsf = w \рн' + W дг = '/2 С (Аф)2 + >/2 ZB (ДрН)2 -
- 72 Z (ZC + В) (АрН0)2. (6.36)
Интегрируя от 0 до — АрН', находим выражение W\f через АрН' и Аф' = Дф —Аф°:
Wlf = '/2 С (Аф')2 + ■/, ZB (АрН')2. (6.37)
Соответственно, уравнение (6.26) можно переписать в виде
А/ = Аф' — Z АрН'. (6.38)
В митохондриях (из печени крысы) площадь сопрягающей мембраны оценивается в 40 м2 на 1 г белка [47]. Электрическая емкость при частотах порядка мегациклов составляет около 1 мкФ/см2 [48]. Отсюда находим С а 0,4 Ф на I г белка или 4 мкэкв-В/г белка. Значение В « 12 мкэкв• В/единица рН на 1 г белка. Принимая величину А/= 270 мВ, получаем W,\t = = 0,15 мкэкв - В на 1 г белка при АрН' = 0 и WAf = 7,2 мкэкв - В на 1 г белка при Аф' = 0. Свободная энергия гидролиза АТФ составляет около 10 ккал/моль или около 0,44 экв-В. Следовательно, W\f соответствует 0,35 мкмоля АТФ на 1 г белка при АрН' = 0 и 17 мкмоль АТФ на 1 г белка при Аф'= 0. Более точные оценки дают соответственно 0,24 и 12 мкмоль АТФ на 1 г белка. Если синтез АТФ сопряжен с переносом двух зарядов электрона, что следует из экспериментально найденного отношения Ф„/2е - = 1 для каждого места фосфорилирования, то необходимое значение Аф' действительно оказывается не менее 200 мВ, т. е. при толщине мембраны порядка 100 А напряженность электрического поля в ней не менее 2-Ю5 В/см. Значение Дф' = 200 мВ эквивалентно вкладу АрН' = 3,5 в общую прото - нодвижущую силу А/.
Разность потенциалов Аф в митохондриальной мембране может возникать не только за счет транспорта протонов, но и за счет транспорта других ионов, происходящего одновременно. Так, для ионов К+ в равновесии справедливо соотношение Нернста
Или
D (ДК+) _ D
D( ДгИ <6-40)
Где D — эффективный буферный дифференциал для К+, определяемый как
П _ d (ДК + ) U d (АрК) •
Соотношение между Аі|з и полным смещением зарядов, вызванным перемещением всех ионов через мембрану, есть
ЈD(Ae+) = Cd(At|>), (6.41)
И связь между Лг|) и полным перемещением зарядов (за исключением перемещения, вызванного ионами К+) дается выражением
£ d (Ае+) — Cd (Лг|)) — d (ЛК+) — Cd (А-ф) + - j - d(Ai|j). (6.42)
Кроме К"**
Ионы к+ считаются здесь находящимися в равновесии. Величина С + DZ~X есть полная эффективная емкость. Ее значение может сильно возрастать, если мембрана проницаема для данного иона.
Если мембрана непроницаема для ионов Н+ и і порознь, но возможен их совместный транспорт в одном направлении, т. е. симпорт (symport) по Митчеллу, то условие равновесия запишется в виде (v — стехиометрические коэффициенты)
Vj Арі - f - vH+ ДрН == 0. (6.43)
Если реализуется антипорт (antiport), т. е. движение ионов і в направлении, противоположном транспорту Н+, то
Vj Арі — vH+ АрН == 0. (6.44)
Симпорт с Н+ установлен, в частности, для некоторых анионов: Ар (дикарбоксилат2") + 2 АрН = 0, Ар (трикарбоксилат3-) + 3 АрН = 0. Возможны и более сложные ситуации, например, Ар (фосфат3-) + 2 АрН + АрК = 0.
Антипорт должен осуществляться для Н+ и катионов.
Соотношения между АрН и Аф можно представить в виде (см. стр. 301)
Суммирование проводится по различным типам реакций, в ходе которых происходит транслокация протонов и других заряженных частиц. При постоянных В я С получаем выражения, аналогичные (6.30) и (6.32):
£дН+ = - ЯДрН, 2>е+ = САг|-. (6.47)
Второе уравнение можно переписать в виде
£ЛН+ + £А1+ = САф, (6.48)
Где Л1+—члены суммы Ае+, отличные от АН+. Из выражений (6.26), (6.47) и (6.48) следует
ДрН с - V ДІ+Mf
~ ~дГ= Л в, г • (6-49)
При равновесном распределении протонов А/ = 0 и
У (д/+)°
Выражение, содержащее лишь отклонения от равновесия, имеет вид
(6.51)
Z ДрН' С - £ (А/+)'/Д?
Af С + B/Z
Таким образом, относительные вклады —ZApH и Аф в А/ зависят лишь от С, В и от числа смещаемых непротонных зарядов. Вообще говоря, сумма (А/+) отрицательна вследствие движения ионов через мембрану по электрическому градиенту, т. е. в направлении, противоположном движению протонов. Эта сумма минимизируется при симпорте протонов и анионов или при антипорте протонов и катионов. Напротив, увеличение переноса ионов в присутствии, скажем, валиномицина (см. стр. 151) должно увеличивать отрицательное значение А/+ и, таким образом, увеличить вклад —ZApH' по сравнению с Аф'.
Не ограничиваясь приведенными соотношениями, Митчелл рассматривает кинетику генерации и затухания АрН' и Аф' в некоторых простейших случаях. Цель этого исследования состоит, в частности, в интерпретации изменений рН, возникающих после достижения равновесия под влиянием импульса окисления — восстановления или гидролиза АТФ. Такой импульс может быть создан добавлением соответствующих веществ.
Полная протонодвижущая сила А/ состоит из специфического потенциала Лф', определяемого электрическими свойствами протонов, и разности —ZApH', определяемой их кислотными свойствами. Сила А/ стремится восстановить электрическое и кислотно-основное равновесие. Митчелл предполагает существование линейной связи между силой и потоком, т. е. рассматривает близкую к равновесию ситуацию. Полную ионную проводимость, включающую протонную, можно описать уравнением
= - gin Mf'- 2 АрН'), (6.52)
Где п — число зарядов иона, эффективная протонная проводимость представлена как доля 1/п от полной проводимости, г. е. g = (l/ti)g, и члены, отвечающие ZgApH для других ионов, считаются пренебрежимо малыми. Опыт дает на 1 г митохоидри - ального белка g— 1,7 мкэкв/(В-с). Для протонной проводимости имеем
D (АН+) ,
—Jt—= — gAf. (6.53)
Из уравнений (6.26), (6.29) и (6.53) следует, что
= Дг|/_2Дрн'), (6.54)
И из уравнений (6.31) и (6.52) находим
C^p - = g(ZApW-nAV). (6.55)
Допустим, что ДрН' и Дф' генерируются импульсом окисления — восстановления, причем скорость переноса Н+ постоянна и равна
(А&р.) =_в(1Ш) =k
^ dt Л/в V dt Л/в
V dt JQlB
Полные скорости генерации ДрН' и Дг|/ даются выражениями
В d (АрН') = gm, _ z ДрН/) _ ^ (б>56)
С d — g(Z ДрН/ - П Аф') + к. (6.57)
Решения этих уравнений при начальных условиях ДрН' = Дф' = = 0 при t = 0 имеют вид
^' = С^ [-Р (" - М-ЧМ]• (6-59)
Где q — Z/B - j - п/С, ш = дД2 + г, s = Z/B — п/С, г = 4Z/CB. При стремлении —ZAрН' к стационарному значению Аф' возрастает до максимума, а затем падает до нуля. Если мембрана проницаема практически лишь для ионов Н+ или ОН - и g = g или
П = 1, то решения (6.56) и (6.57) не могут быть получены в виде (6.58) и (6.59). В этом специальном случае уравнения (6.56) и (6.57) не независимы и их можно переписать в виде
D (ДрН') _
(6.60) (6.61)
D (ДрН') dt
С d (Аф')
Dt
В
Интегрирование (6.60) и (6.61) дает
- Z ДрН' =
BgO/C + Z/B)
(6.63)
Zk
[1 — ехр (— g(\/C ZjB)t)\ (6.62)
Аф' = Ц - С (- Z АрН').
В этом случае генерация Аф' и —ZApH' происходит синхронно. Время затухания обеих величин до половины исходного значения определяется в основном величиной С. Для митохондрий оно составляет около 1,5 с. Вообще говоря, временной ход —ZApH' зависит от значения п, при больших п это время составляет около 80 с.
Дальнейшие подробности, относящиеся к теории Митчелла, изложены в работах [42, 44]. На языке линейной неравновесной
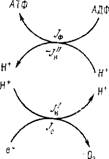
Рис. 6.14. Схема потоков в химиосмотической модели.
ОнК< ) « і
А
'фН
Ф ф Н ~ ^фН^ф I ^Н
Ill
Термодинамики (см. § 6.3) соответствующие соотношения можно записать на основе упрощенной схемы, приведенной на рис. 6.14 [34]. В области / имеем (ср. стр.294)
/' = L' АДН + L'sf'
(6.64)
}О = LoH ААн + L,
И в области II
L!'stl+L>'Aii
(6.65)
В области / окисление вызывает транспорт протонов в направлении, противоположном АДн, в области // спонтанный поток создает фосфорилирование. Общий поток протонов
J Н = }'п + /н,
Или
Основное предположение теории Митчелла состоит в том, что коэффициент прямого сопряжения окисления и фосфорилирования равен нулю (£фО = 0). Иными словами, если Арн поддерживается постоянным, то фосфорилирование должно быть независимым от окисления, и наоборот. В частности, при АДн = 0 разобщение полное и /ф = 0, если = 0 при любом значении /о, а также /0 = 0, если si"= 0 при любом значении /ф.
Теория Митчелла — феноменологическая теория, не рассматривающая механизм процесса и не учитывающая электронно - конформацнонные свойства митохондриальной системы. Тем не менее, эта теория позволяет прийти к ряду конкретных выводов, подлежащих прямой экспериментальной проверке. Вместе с тем подлежит проверке и предполагаемая в теории Митчелла близость процесса к равновесию.