Электронный Парамагнитный резонанс в биологии
Сверхтонкая структура в спектрах иопов металла
Общая картина сверхтонкой структуры спектров ЭПР обсуждалась в начале книги, в частности в разд. 1.5, а сверхтонкая структура спектра свободных радикалов более подробно рассматривалась в гл. 4. Как уже было указано, ионы металлов дают обычно совершенно иную сверхтонкую структуру в спектрах ЭПР, нежели свободные радикалы. В последнем случае неспаренный электрон обычно находится на делокализованной орбитали и., следовательно, взаимодействует одновременно с несколькими ядрами, тогда как у ионов металлов неспаренный электрон в большинстве случаев локализован преимущественно на самом ионе металла, и поэтому сверхтонкое расщепление обусловлено в основном взаимодействием неспаренного электрона с ядерным спином именно этото иона.
Так, в простейшем случае, скажем, неорганической соли, содержащей ионы меди, должно иметь место прямое взаимодействие неспаренного электрона с ядерным спином / атома меди, равным 3/2, и, следовательно, наблюдается (21 + 1) линий, т. е. сверхтонкая структура состоит из четырех линий. Такая сверх тонкая структура была показана на фиг. 11,А для монокристалла, содержащзго ионы Сп2+, и на фиг. 12,Б для ферментной системы, в растворе, содержащей те|же ионы. На фиг. 12.Б сразу обращает на себя внимание еще одна характерная черта спектра, а именно возможность легко идентифипчровать сверхтонкую структуру из четырех линий около положения |1, несмотря на беспорядочную ориентацию ионов металла в растворе. Такое сохранение характерной сверхтонкой структуры ионов металла в раствсре дает возможность характеризовать входящий в состав фермента ион металла в условиях, очень близких к условиям in vivo, что имеет существенное значение для биохимических исследований.
|
179 |
Однако даже если электрон в основном локализован на каком - то одном ионе металла, его молекулярная орбиталь может охватывать и некоторые соседние лигандные атомы. В этом случае возникает дополнительное сверхтонкое взаимодействие с ядерными спинами этих лигандных атомов, окружа гащих ион металла. В биологических соединениях часто встречается структура из четырех атомов азота, окружающих ион металла. Хорошими примерами систем такого рода служат плоские молекулы порфирипа и гема: каждая из них содержит центральный атом металла в окружении четырех атомов азота и в свою очередь является частью гораздо более протяженной плоской молекулярной единицы - Очень похожа на них и молекула фталоциапина, структура которой уже приводилась в качестве примера на фиг. 14,А. В этой молекуле можно ввести в центральное положение ионы самых
различных металлов; вид сверхтонкой структуры спектра ЭПГ при введении Си2+ показан на фиг. 14,Б. ©та сверхтонкая структура получена на монопристаллах, и поэтому ни усреднения, ни уширения линий не наблюдается. Как уже было сказано при кратком рассмотрении этого спектра в разд. 1.5, на каждой из четырех групп линий заметно добавочное расщепление, обуслов ленное суперсверхтонкой структурой, возникающей в результате
|
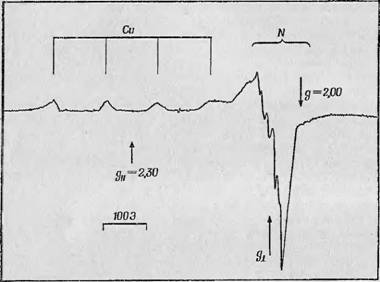
Фиг. 80. Спектр ЭПР раствора медьсодержащегЗЯ кональбумина [6]. Четыре линии располОженныйПо Qoe стороны от обусловлены ядром медн,^ супер - оверхтонкие линии вокцуг gj_ |обусловленй взаимодействием с атомами азота, окружающими атом меди. |
Взаимодействия неспаренного электрона с четырьмя атомами азота, окружающими атом меди [5]. Соотношение величин расщепления суперсверхтонкой структуры и расщепления между сверхтонкими компонентами, обусловленными медью, ирямо шо - казывает, какая часть спиновой плотности неспаренных^'дек- тронов находится на этих лигандных атомах и, следовательно, каков характер распределения их молекулярной орбитали по самой молекуле.
При исследовании растворов сохраняются щ разрешаются даже эти суперсьерхтонкие ^компоненты. На фиг. 80 попами спектр, наблюдаемый в водных растворах кональбумина, содержащего медь ГШ В левой части спектра вокруг положения gfl ясно видны четыре отдельные линии, обусловленные самими атомами
|
Таблица 3 Сверхтонкая структура и типичные значения ^-факторов ионов металлов, входящих в состав ферментов
|
Меди, а справа — интенсивная одиночная линия, связанная с gj_- компонентами. Однако эта линия тоже оказывается сложной, так как на нее накладываются многочисленные сверхтонкие компоненты, обусловленные взаимодействием неспаренного электрона с атомами азота, окружающими атом меди; сверхтонкая структура самого атома меди при данной ориентации практически исчезает. Этот пример еще раз показывает, что даже при исследовании водных растворов ферментов можно получить ценные количественные данные об их сверхтонкой структуре.
В табл. 3 суммированы данные о величине ядерных спинов и g-фактора, а также о характере сверхтонкого расщепления в спектрах металлов, входящих в состав ферментов. Этой таблицей можно воспользоваться при проведении сравнительных исследований ферментативных реакций, когда требуется идентифицировать участвующие в реакции ионы металлов и следить за изменением их валентности. Примеры таких исследований будут приведены в следующих разделах этой главы.