СОВРЕМЕННАЯ ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ
|
В |
1905 году, незадолго до смерти, Д. И. Менделеев писал: «...периодическому закону будущее грозит не разрушением, а только надстройки и развитие быть обещаются». История дальнейшего развития науки показала всю справедливость этого предвидения.
Конец XIX и начало XX века ознаменовались рядом крупных научных открытий в области физики и химии. Эти открытия заставили учёных коренным образом пересмотреть представление об атоме и в особенности об атомном весе, этом наиболее индивидуальном качестве химического элемента, на которое опирался в своей работе Д. И. Менделеев.
В 1895 году Рентгеном были открыты новые, неизвестные дотоле лучи с большой проникающей способностью [3]).
В поисках других подобных лучей профессор Бекке - рель открыл в следующем году вещество, которое самопроизвольно, без влияния внешнего воздействия, испускает лучи, обладающие огромной проникающей способностью. Это было соединение урана. Явление самопроизвольного распада было названо радиоактивностью (излучением) .
Вскоре было установлено, что радиоактивность — явление, распространённое в природе. Оно было обнаружено у элементов тория, актиния и других.
М. Складовская-Кюри, исследуя урановую руду, открыла новый элемент — радий, расположенный в современной периодической таблице элементов под номером 88. Изучение его свойств показало, что этот элемент родственен барию.
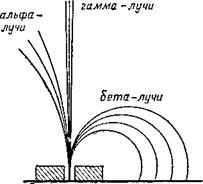
Была установлена природа радиоактивного излучения. Как оказалось, при радиоактивном распаде вещества выделяются три рода лучей: они были названы альфа-, бета - и гамма-лучами (альфа, бета и гамма — первые буквы греческого алфавита).
Альфа - и бета-лучи отклоняются в магнитном поле и, следовательно, являются электрически заряженными (рис. 4).
Гамма-лучи магнитным полем не отклоняются; по природе они родственны лучам Рентгена.
Дальнейшее исследование радиоактивных лучей выявило, что альфа-лучи представляют собой поток положительно заряженных частиц, масса которых равна массе
|
Рис. 4. Излучение радия под действием магнитного поля. |
Атома гелия. Бета-лучи несут на себе отрицательные электрические заряды. Таким образом, открытие радиоактивных веществ показало, что атом не является простейшей неделимой частичкой.
И действительно, вскоре было установлено, что атом состоит из положительно заряженного ядра, вокруг которого на определённых расстояниях вращаются отрицательно заряженные частицы — электроны. Электроны образуют так называемые электронные оболочки атома. Заряд ядра атома уравновешивается суммой зарядов находящихся в нём электронов.
Хотя ядро атома занимает ничтожно малую часть объёма атома, в нём сосредоточена почти вся его масса.
Самый простейший атом — атом водорода. Он имеет ядро, несущее на себе один положительный заряд, и один электрон, который вращается вокруг ядра.
Электроны располагаются в атомах как бы по слоям, распределены в них на определённых уровнях, причём в каждом слое может находиться только определённое число электронов. Например, первый слой «вмещает» всего два электрона, второй — восемь и т. д.
Атомы, как уже говорилось, в целом электронейтраль - ны. Однако при известных условиях они способны терять из внешней оболочки свои электроны или, наоборот, захватывать на свою внешнюю оболочку «чужие» электроны. В этом случае атом становится электрически заряженной частичкой — ионом.
Притягиваясь друг к другу, различно заряженные ионы — положительные и отрицательные — и образуют молекулы сложных веществ.
Металлы относятся к элементам, которые легко отдают свои электроны. Наоборот, неметаллы — металлоиды — стремятся «захватить» во внешнюю оболочку «лишние» электроны.
Некоторые элементы имеют свойства как металлов, так и неметаллов. Их называют амфотерными.
Способность отдельных атомов отдавать определённое число электронов или присоединять их и определяет в а - лентность химических элементов.
Исследования строения атома показали связь между химическими свойствами элементов и строением электронных оболочек атома.
Возьмём для примера химический элемент литий (1л), начинающий второй период. В его электронной оболочке имеется три электрона. Два из них располагаются в первом слое, а третий образует новый слой, удалённый от ядра на большее расстояние. Этот последний электрон менее устойчив в системе; атом может легко его отдать, превращаясь при этом в положительно заряженную частицу — положительный ион.
Благодаря этому литий и принадлежит к химически активным элементам.
У каждого следующего за литием элемента — вплоть до неона — во внешнем электронном слое прибавляется по одному электрону. Неон завершает собой второй период таблицы Менделеева; в его внешнем электронном слое все восемь мест оказываются занятыми. У неона очень трудно «изъять» любой из восьми электронов его наружного электронного слоя.
Именно поэтому неон и является инертным газом: только с большим трудом он вступает в химические соединения с другими элементами.
Новый — третий — период в системе Менделеева начинает элемент натрий. У этого элемента 11 электронов, из них 10 находятся в ближних к ядру двух электронных слоях, полностью завершённых, а последний, одиннадцатый, начинает собой «застройку» нового, третьего, внешнего электронного слоя. Этот одиннадцатый этектрон ещё легче, чем у лития, может быть оторван от атома, так как он находится ещё дальше от ядра. Поэтому натрий, как и литий, характеризуется высокой химической активностью.
Третий период заканчивает аргон; он, как и неон, входит в группу инертных газов Его внешний электронный слой заполнен уже целиком, включая в себя также восемь электронов, и он поэтому «безразличен» к другим химическим элементам.
Таким образом, завершённой электронной группировкой (слоем) в атоме заканчивается каждый период химических элементов в таблице Менделеева. Первому периоду соответствует слой, состоящий из двух электронов, второму и третьему — слой из восьми электронов. Далее следуют четвёртый и пятый периоды (см. таблицу Менделеева), объединяющие в электронных слоях по 18 электронов.
Шестой период, состоящий из 32 элементов, содержит электронный слой, имеющий 32 электрона.
У инертных элементов этих периодов внешняя электронная оболочка состоит из такой же устойчпзой, «завершённой» группировки электронов, какую имеют неон и аргон.
Седьмой период — незаконченный, он не имеет завершённой электронной оболочки.
Если мы проследим, как в связи со строением электронных оболочек атомов изменяются химические свойства элементов, то мы увидим, что с увеличением числа электронов во внешней оболочке атомов каждого периода постепенно уменьшается способность атомов терять свои «внешние» электроны.
Одновременно с этим начинает проявляться другая способность атомов — легко «достраивать» свою внешнюю электронную оболочку до наиболее устойчивой структуры, то-есть до восьми электронов. Эта способность наибольшая у электронов седьмой группы — у фтора, хлора и других. Поэтому атомы этих элементов легко образуют отрицательно заряженные ионы.
Как вы уже знаете, каждая группа элементов в периодической таблице объединяет в себе элементы, родственные по химическим свойствам. Решающую роль в этом играет структура внешней электронной оболочки.
Зная, в какую группу входит тот или иной элемент, можно заранее предугадать его химические свойства и родство с другими элементами.
Элементы средних групп, в особенности четвёртой (например, углерод, кремний, олово, свинец), как мы уже теперь легко можем сами подсчитать, содержат на внешней оболочке четыре электрона. Элементы этих групп имеют или очень слабо выраженные свойства металлов, или свойства металлоидов (например, углерод, кремний), или свойства металлов и металлоидов одновременно. К последним относятся, например, олово и свинец. Эти элементы обладают одинаковой способностью образовывать как положительно, так и отрицательно заряженные ионы.
Изучение электронного строения атомов показало также, что место химического элемента в таблице Д. И. Менделеева определяется не атомным весом элемента, а величинойза - ряда его ядра. Положительный заряд ядер различных химических элементов различен: заряд ядра водорода, как говорилось, равен единице, заряд ядра гелия равен двум, лития — трём единицам и т. д. Иными словами, заряд ядра у различных атомов численно совпадает с порядковыми номерами химических элементов втаблице Менделеева. Так, заряд ядра лития равен трём единицам и его порядковый номер в таблице — три, заряд ядра натрия 11, таков же и его порядковый номер в таблице и т. д.
Таким образом, в настоящее время периодический закон Д. И. Менделеева формулируется следующим образом: свойства химических элементов находятся в периодической за в и с имо сти от их порядковых номеров.
Очень интересно отметить, что при распределении элементов в своей таблице Д. И. Менделеев безошибочно поставил на свои места такие элементы, как кобальт и никель, иод и теллур. Как теперь установлено, такое их расположение, хотя оно и нарушает последовательность в возрастании атомных весов, в точности соответствует заряду ядер атомов этих элементов!
Изучение радиоактивности привело учёных к открытию, что среди радиоактивных элементов имеются такие, которые, несмотря на различие в атомном весе, обладают совершенно одинаковыми химическими свойствами. Эти элементы не могут быть химически отделены друг от друга.
Такие элементы были названы изотопами.
Дальнейшие исследования показали, что изотопы имеются не только среди радиоактивных, но и среди большинства элементов периодической системы. В природе химические элементы оказались «смешанными», состоящими из нескольких изотопов.
В настоящее время известно уже до 1000 различных изотопов.
Явление изотопии изменило весь внешний облик периодической системы. Как теперь установлено, существуют многие группы химических элементов — изотопов, каждая из которых занимает только одну клетку, одно место в таблице Менделеева.
Явление изотопии дало также возможность объяснить нарушения в последовательности атомных весов элементов, встречающихся в таблице Д. И. Менделеева,— у теллура, иода и других.
Дальнейшее уточнение и пополнение таблицы Менделеева принесло изучение атомного ядра.
Первое расщепление атомного ядра было произведено 35 лет назад, в 1919 году, когда при облучении («бомбардировке») атомов азота альфа-частицами, вылетающими при распаде радия, были получены атомы одного из изотопов кислорода (с атомным весом 17). В опытах по расщеплению ядер было установлено, что в состав ядер входят положительно заряженные элементарные частицы — протоны, или, иными словами, ядра атомов водорода (как известно, заряд ядра атома этого элемента равен единице и является поэтому минимальным положительным зарядом ядерной частицы).
Было предположено, что в состав атомных ядер входят протоны и электроны. Однако это предположение оказалось неверным.
В 1932 году при «бомбардировке» альфа-частицами атомов элемента бериллия была открыта новая частица, входящая в состав атомного ядра, названная нейтроном. Масса этой частицы почти точно равна массе протона, но в отличие от него нейтрон не несёт никакого заряда.
Открытие нейтрона позволило установить строение атомных ядер. Советский физик Д. Д. Иваненко предложил рассматривать ядро как систему, состоящую из нейтронов и протонов.
Таким образом, на основе известных нам теперь данных можно считать, что все атомы химических элементов построены из трёх основных частиц: протонов, нейтронов и электронов. Первые две частицы определяют строение ядра, а также величину атомного веса, а электроны — внешнюю оболочку атома.
Было установлено, что для каждого ядра существуют определённые соотношения протонов и нейтронов, в противном случае ядро перестаёт быть устойчивым.
Если каким-нибудь образом изменить соотношение нейтронов и протонов в ядре, то при избытке первых в ядре происходит превращение нейтронов в протоны с излучением одного электрона, который увеличивает тем самым заряд ядра на одну единицу. Наоборот, при избытке протонов последние превращаются в нейтроны, излучая при этом положительно заряженную элементарную частицу — п о з и т р о н,— и заряд ядра понижается на единицу.
Наиболее устойчивой комбинацией протонов и нейтронов считается такое их количество, которое соответствует образованию альфа-частицы, то-есть два протона и два нейтрона.
Дальнейшие исследования состава ядер отдельных элементов показали, что у лёгких атомов число нейтронов и протонов равно, и поэтому такие атомы устойчивы.
Но по мере возрастания атомного веса избыток нейтронов становится всё более значительным, а, начиная с элемента № 81 (таллий), эта разница в соотношении нейтронов и протонов возрастает ещё быстрее. Вот почему среди элементов, следующих за таллием, мы находим большое число естественных радиоактивных элементов.
Новые достижения в науке об атомном ядре связаны с работами французских учёных супругов Жолио-Кюри. Облучая альфа-частицами атомы кремния, алюминия и бора, они получили искусственные радиоактивные изотопы фосфора и азота.
Позднее получены искусственным путём радиоактивные изотопы почти для всех элементов. При этом были получены последние четыре недостающие элемента периодической таблицы с атомными номерами 43, 61, 85 и 87.
Элемент № 43 — технеций (Тс)—был открыт в 1937 году при «бомбардировке» молибдена нейтронами и ядрами изотопа водорода — так называемого тяжёлого водорода. Опыты показали, что технеций по своим свойствам гораздо больше похож на более тяжёлый, родственный ему элемент рений, чем на вышестоящий в группе марганец.
Назван он был технецием потому, что был первым элементом, полученным искусственным путём.
Элемент № 61 —прометий (Рт) —был найден при исследовании продуктов деления ядер атомов урана. Этот элемент входит в состав группы редкоземельных элементов и по своим свойствам похож на предшествующий ему элемент неодим (см. таблицу Менделеева).
Элемент № 85 — астатин (А1:) — был получен из висмута действием альфа-частиц. При низких температурах он летуч. Учёные, открыв этот элемент, дали ему название нестабильный, что по-гречески и означает астагин (так как это единственный галоген, не имеющий стабильных изотопов).
И, наконец, элемент № 87 — франций (Рг) — был получен при альфа-распаде актиния. Это — наиболее тяжёлый из всех известных нам щелочных металлов.
Существование технеция, астатина и франция также было предсказано Менделеевым.
Чтобы закончить рассмотрение периодического закона химических элементов, необходимо ещё остановиться на новых элементах выше № 92, так называемых трансурановых или заура новых элементах.
Попытки найти или получить заурановые элементы делались уже давно, но получены эти элементы были лишь после того, как в 1939 году было открыто явление деления ядер урана нейтронами.
Процесс этого деления урана состоит в следующем. Уран встречается в природе в виде смеси изотопов с массой главным образом 235 и 238. Урана с массой 235 очень мало — не более 0,7 процента, остальная часть приходится на уран 238.
При обстреле атомов урана нейтронами уран 235 захватывает один нейтрон и превращается в уран с массой 236. Этот изотоп нестоек и в свою очередь приводит к распаду ядра с цепью радиоактивных превращений. При этом,— что очень важно,— всегда освобождается два - три нейтрона, которые могут вызвать продолжение такой, как называют учёные, цепной ядерной реакции. Это означает, что если вылетевшие нейтроны вновь попадут в следующее ядро урана 235, они будут продолжать реакцию деления ядра и т. д. Эта реакция и является основой для получения атомной, или вернее, ядерной энергии[4]).
Иначе ведёт себя изотоп урана с массой 238. При его обстреле медленными нейтронами последние захватываются ядром. Ядро переходит в неустойчивое состояние, в результате чего оно выбрасывает из себя бета-частицу сначала одну, а затем и другую. Заряд ядра при этом изменяется, и мы получаем новые элементы с порядковыми номерами 93 и 94.
Эти элементы были названы нептунием и плутонием.
Так претворена была в жизнь мысль учёных о получении искусственных элементов через ряд радиоактивных превращений.
Нептуний, а за ним плутоний были открыты в 1940 году. В последующие годы получены были изотопы нептуния, наиболее устойчивым из которых является нептуний с массой 237. Известны изотопы и плутония. Наиболее интересным оказался изотоп с массой 239 — он хотя и радиоактивен, но распадается очень медленно.
В настоящее время получены также и другие трансурановые элементы с порядковыми номерами — 95 (америций), 96 (кюрий), 97 (берклий) и 98 (калифорний).
Америций с массой 241 распадается медленно, что позволило исследовать химические свойства этого элемента. Удалось даже получить его в виде соединения.
Изотоп кюрия с массой 242 распадается медленно, испуская альфа-частицы, что также позволило учёным изучить его химические свойства.
Все трансурановые элементы составляют особую группу, сходную с группой редкоземельных элементов.
Эта группа объединяет в себе элементы, начиная от № 89 (актиний) и далее. Именуется она, как уже говорилось, группой актинидов.
* *
*
Таков путь развития взглядов на природу основных веществ мироздания — химических элементов.
Многое изменилось с того времени, когда Менделеев впервые расположил химические элементы в их естественной последовательности.
Однако ни явление изотопии, ни открытие и получение новых элементов, ни ряд других фактов не опровергли,
А, наоборот, только укрепили, подтвердили правильность и незыблемость великого закона природы, открытого русским учёным Дмитрием Ивановичем Менделеевым.