О ВОДЕ
|
Д |
Остаточно одного взгляда на карту земного шара, чтоэы убедиться, насколько вода распространена в природе: океаны и моря, вечные льды Арктики и Антарктики, реки и озёра покрывают 3Д поверхности Земли. А ведь это ещё не всё. В атмосфере всегда находятся пары воды, земная кора содержит около 9 процентов влаги. Кроме того, вода входит в состав всех растительных и животных организмов.
Вода играет исключительную роль во многих процессах, протекающих в мёртвой и живой природе. Она служит человеку для питья, приготовления пищи и мытья. В технике вода используется для производства пара и как
охлаждающая жидкость. Естественные или искусственно созданные водопады («белый уголь») дают нам электроэнергию. Но самое замечательное и важное свойство воды заключается в том, что она растворяет очень многие вещества. Поэтому в природе и в химической промышленности вода очень часто служит средой, в которой протекают различные реакции.
|
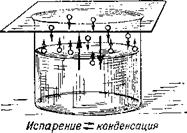
Растворение кристаллизаций Рис. 8. Сходство между испарением и растворением, кристаллизацией и конденсацией (молекулы обозначены кружочками со стрелками). |
 Что такое растворы. Растворы являются сложными системами. Они состоят по меньшей мере из двух веществ: из растворителя и растворённого вещества. В растворе может находиться несколько растворенных веществ одновременно. В стакане сладкого чая, нанример, содержатся растворённые вещества чая, окрашивающие воду, и сахар. Растворы однородны и этим отличаются от смесей. Но ведь и химические соединения однородны. Чем же от них отличаются растворы? Да тем, что растворы не имеют постоянного состава. Мы можем растворить в литре воды 1, 2 или 100 граммов поваренной соли и во всех этих случаях получим однородный раствор. Химическое же соединение, как мы уже говорили, имеет строго постоянный состав.
Что такое растворы. Растворы являются сложными системами. Они состоят по меньшей мере из двух веществ: из растворителя и растворённого вещества. В растворе может находиться несколько растворенных веществ одновременно. В стакане сладкого чая, нанример, содержатся растворённые вещества чая, окрашивающие воду, и сахар. Растворы однородны и этим отличаются от смесей. Но ведь и химические соединения однородны. Чем же от них отличаются растворы? Да тем, что растворы не имеют постоянного состава. Мы можем растворить в литре воды 1, 2 или 100 граммов поваренной соли и во всех этих случаях получим однородный раствор. Химическое же соединение, как мы уже говорили, имеет строго постоянный состав.
Растворы однородны потому, что растворитель «раздробляет» растворяемое вещество на отдельные молекулы, а иногда и на более мелкие частицы, с которыми мы познакомимся позже. Растворение вещества похоже на его испарение, а выделение вещества из раствора, то-есть кристаллизация — на сгущение паров в жидкость, конденсацию (рис. 8).
При 20 градусах Цельсия в одном литре воды может раствориться 263,9 грамма поваренной соли. Если мы возьмём 300 граммов соли на литр воды, то 36,1 грамма останутся в виде кристаликов. Однако это не значит, что процесс растворения прекратился совершенно. Ведь все молекулы соли «равноправны», все они стремятся перейти в раствор. Но по мере того, как количество растворённой соли увеличивается, усиливается и стремление растворённых молекул выкристаллизоваться из раствора. К моменту, когда в 1 литре воды растворится 263,9 грамма соли, оба эти процесса уравновешиваются; число молекул, переходящих из кристаллов в раствор, становится равным числу молекул, выделяющихся из раствора на поверхности кристаллов. Процессы, в том числе и химические реакции, протекающие, подобно описанному, в двух противоположных направлениях, называют обратимыми. Когда скорости противоположно направленных процессов уравниваются, наступает равновесие. Раствор, находящийся в равновесии с ещё нерастворённым веществом, называют насыщенным. Насыщенный раствор — самый «крепкий», самый концентрированный раствор, какой только может дать растворяемое вещество (если не считать редких случаев образования нестойких пересыщенных растворов). Поэтому, когда говорят о растворимости вещества, всегда подразумевают то количество вещества, которое образует насыщенный раствор.
Различные вещества растворяются в воде по-разному: одни хорошо растворяются, другие совсем не растворяются, а некоторые вещества смешиваются с водой в любых отношениях — их растворимость не ограничена. Это видно из следующей таблички:
|
Вещество |
Его Формула |
Растворимость в граммах на 100 граммов воды (при 20 градусах) |
|
Серная кислота.... |
Н2804 |
Не ограничена |
|
Поваренная соль.... |
№С1 |
26,39 |
|
Сода стиральная. ♦ • • |
№2СОя |
17,8 |
|
Сода питьевая.... |
№<,НС03 |
8,09 |
|
Гипс.................................. |
Са$04 |
0,19 |
|
Мел.................................... |
СаС03 |
0,018 |
|
Кварц (белый песок) . |
БЮо |
0 |
|
Железо............................... |
Ре |
0 |
Растворимость вещества зависит от температуры. При
20 градусах в 100 граммах воды растворяется только 17,8 грамма соды, при 30 градусах — 29 граммов, а при 36 градусах уже 33,8 грамма.
А что же произойдёт, если мы приготовим насыщенный раствор соды при 36 градусах, а затем охладим его до 20 градусов? В растворе останется такое количество соды, которое растворяется при 20 градусах, а весь излишек выделится из раствора в виде кристаликов.
Разницу в растворимости при различных температурах используют для очистки веществ от примесей. При этом большая часть примеси остаётся в растворе, а отделённые от него кристаллы оказываются более чистыми, они содержат меньше примеси. Повторяя кристаллизацию несколько раз, можно получить химически чистое вещество.
Растворителем может быть не только вода, но и другие жидкости — бензин, спирт, эфир и т. п.
Чем дождевая вода отличается от речной, а речная — от морской? Вода — хороший растворитель. Поэтому в природе она никогда не встречается в совершенно чистом виде. Она всегда содержит растворённые вещества. Разницу между водами различного происхождения можно легко определить, испарив воду и определив количество и состав сухого остатка. Из всех природных вод наименьший сухой остаток даёт дождевая вода, значительно больший — речная, а самый большой остаток даёт морская вода (рис. 9). Одна тонна дождевой воды (разумеется освобождённой от частиц пыли) даёт при полном испарении не более 50 граммов твёрдого остатка, тонна речной воды до 1 600 граммов, а морской — около 35 килограммов!
Дождевая вода образуется из влаги воздуха и поэтому содержит очень мало растворённых веществ: кислород, азот, углекислоту, а иногда окислы азота и аммиачную селитру (NH4NO3), образующиеся в воздухе при грозовых разрядах.
Сухой остаток морской воды содержит около 78 процентов поваренной соли, около 11 процентов хлористого и 5 процентов сернокислого магния и очень мало — около
4 процентов — различных солей кальция (соли кальция используются микроорганизмами для построения раковин). Наоборот, в речной воде большая часть растворённых солей — до 94 процентов — соли кальция: сернокислая, углекислая и др.
Почему в чайнике нарастает накипь и как её снять*
При длительном пользовании чайником на его стенках и на дне нарастает слой накипи. Накипь состоит из солей. При нагревании вода частично испаряется, и плохо растворимый сернокислый кальций выпадает в осадок.
В образовании накипи участвуют и двууглекислые соли кальция и магния — Са (НС03)2 и (НСОзЬ; ПРИ тем~ пературе кипения воды они разлагаются и образуют значительно менее растворимые углекислые соли, выпадающие в осадок:
Са (НС03)2 —> СаС03 [ + Н20 + С02.
Снять накипь можно продолжительным кипячением в чайнике раствора соды. При этом идёт реакция двойного обмена, при которой сернокислый кальций переходит в углекислый кальций:
СаБ04 + Кта2С03 -> СаС03 + Иа2504.
Углекислый кальций затем легко растворяется в уксусной кислоте.
Накипь в чайнике — ещё полбеды, а вот в паровых котлах она очень вредна, так как плохо проводит тепло. Уже пятимиллиметровый слой её требует полуторного расхода топлива для нормальной работы котла. Накипь к тому же и опасна. Закупоривая тонкие трубки, она может привести даже к взрыву котла. Поэтому воду перед использованием в паровых котлах часто освобождают от солей кальция и магния.
Эти примеры показывают, что технические свойства воды зависят от содержания в ней кальциевых и магниевых солей. Различают «мягкую» и «жёсткую» воду. Жёсткость воды тем больше, чем больше в ней кальциевых и магниевых солей. Чем их меньше, тем мягче вода.
В химической практике часто необходима чистая вода. Как её получить?
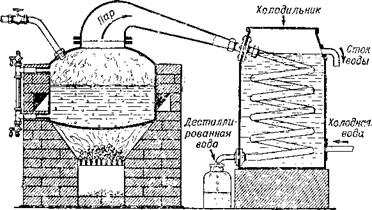
Чистая вода и её физические свойства. Вода легко очищается перегонкой, «дестилляцией». Этот способ очистки воды — воспроизведение процесса, постоянно протекающего в природе: испарения воды с поверхности водоёмов, образования облаков и туч и возвращения воды на землю в виде дождя. Перегонка воды на химических заводах производится в специальных перегонных кубах (рис. 10). Пары кипящей воды, поступая в змеевик холодильника, вновь превращаются в воду, уже не содержащую растворённых твёрдых веществ. Подобным же образом очищают и другие жидкие вещества.
Чистая вода замерзает при нуле градусов, а кипит при 100 градусах (при атмосферном давлении). Она наиболее плотна при 4 градусах. Количество тепла, необходимое для нагревания одного грамма воды на один градус, принимают за единицу теплоты и называют её калорией. Для нагревания 1000 граммов воды на один градус требуется уже килокалория, 1000 калорий.
Совершенно чистая вода — один из самых плохих проводников электрического тока.
|
Рис. 10. Перегонка воды. |
Как молекулы различных веществ ведут себя в воде?
По поведению в растворах все вещества можно разделить на 2 группы: вещества, проводящие электрический ток, — электролиты и вещества, не проводящие ток, — неэлектролиты. Поваренная соль — электролит, сахар — неэлектролит. Молекула сахара состоит из элементов-неметаллов (С, Н, О), а молекула соли — из металла (Ыа) и неметалла (С1). Мы уже познакомились раньше (стр. 21) с тем, что образованная металлом и неметаллом молекула состоит из положительно заряженной частички металла (атом, отдавший электрон) и отрицательно заряженной частички неметалла (атом, захвативший электрон). Из этих притягивающих друг друга частичек состоит весь кристалл соли. При растворении в воде кристалл разрушается и составляющие его заряженные частички, ионы, становятся свободными и подвижными, — вода препятствует взаимному притяжению этих частиц в 81 раз сильнее, чем воздух. Распад молекул
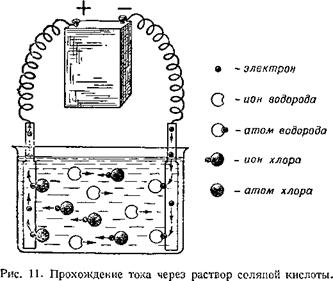
Электролитов называется электролитической диссоциацией. Стоит только удалить растворитель— испарить воду, — как ионы вновь образуют кристаллы. Название «ион» происходит от греческого слова «идущий». Оно дано заряженным частичкам потому, что под действием тока они перемещаются: ионы металлов — ка
Тионы —• направляются к отрицательному полюсу, а ионы неметаллов — анионы — к положительному полюсу, как это показано на рисунке 11. Именно это движение
|
|
Ионов представляет электрический ток в растворе. Наш рисунок показывает также, что, дойдя до отрицательного электрического полюса, ион металла получает у него электрон и превращается в незаряженный атом; ион неметалла отдаёт свой электрон положительному полюсу и также превращается в незаряженный атом. Таким образом, электрический ток превращает ионы в атомы. Но так действует только постоянный ток, ток, идущий только в одном направлении. Он используется в промышленности для получения простых веществ — металлов, хлора и др. — из их солей. Такое разложение веществ током называют электролизом.
Переменный ток, направление которого часто меняется (например, в осветительной сети — 50 раз в секунду), тоже проходит через растворы электролитов. Но «разрядки» ионов и превращения их в атомы в этом случае уже нет: ионы только получают «толчки» то в одном, то в другом направлении и не успевают за такой короткий промежуток времени добраться до электродов.
Хотя ионы и заряжены, раствор в целом нейтрален, потому что число зарядов анионов равно числу зарядов катионов. Например, при электролитической диссоциации хлористого магния образуется один двухзарядный катион магния и два однозарядных аниона хлора:
1^С12^Л^++ + 2СГ.
Почему не все вещества диссоциируют в растворах? Молекулы сахара, спирта, эфира и др. не содержат элементов-металлов. Неметаллы же, как мы уже знаем, образуют друг с другом соединения, в которых пары электронов оказываются в совместном владении ядер соединяющихся атомов (рис. 5). Значит, молекулы таких соединений при растворении не могут образовать ионов.
Что такое «кислоты» и чем они отличаются от «щелочей». Вода легко взаимодействует со многими окислами. Окислы металлов, соединяясь с водой, образуют щёлочи, а окислы неметаллов — кислоты. Едкий натр (каустик), гашёная известь — щёлочи. Наиболее известные кислоты — соляная, серная, азотная, фосфорная. Как же эти соединения диссоциируют в водных растворах?
В щелочах положительным ионом — катионом является ион металла. Остальная же часть молекулы щёлочи — группа атомов ОН или гидроксил — даёт отрицательный ион, анион. Едкий натр диссоциирует в растворе на 2 иона:
ИаОН Иа+ + ОН".
Гашёная известь (гидрат окиси кальция) при диссоциации тоже даёт металлический ион и гидроксильный: Са(0Н)2^Са++ + 20Н -
У разных щелочей различны только положительные ионы. Отрицательным же ионом у всех щелочей является гидроксил-ион. Поэтому любое соединение, образующее в водном растворе гидроксильные ионы, причисляют к классу щелочей.
В кислотах же роль металла всегда играет водород. Кислоты диссоциируют так:
НС1 Н+ + СГ; H2S04 л 2Н+ + S04'
Соляная кислота серная кислота
Н3Р04 ЗН+ + РОГ
Фосфорная кислота
Мы видим, что все кислоты образуют ионы водорода и отличаются только отрицательными ионами. Значит, ионы водорода и служат признаком кислот. Именно от них зависят реакции кислот: водород любой кислоты вытесняется активным металлом или обменивается на металл при смешении кислоты со щёлочью.
Многие окрашенные вещества меняют цвет при действии кислот и щелочей. Например, фиолетовая краска — лакмус синеет от действия щелочей и становится красной от кислоты. Лакмусом часто пользуются для распознавания кислот и щелочей.
Кислоты отличаются по силе, по активности. Так же различаются и щёлочи. Чем больше молекул кислоты или щёлочи распадается в растворе на ионы, тем сильнее кислота или щёлочь, тем легче они вступают в реакцию и тем быстрее она идёт.
К сильным щелочам относятся едкий натр, едкий калий, к сильным кислотам — соляная, серная, азотная.
Что получается при смешении кислоты со щёлочью. Кислота даёт ион Н+, щёлочь — ОН~. При смешении кислоты со щёлочью из водородных и гидроксильных ионов обязательно образуется вода, так как оба эти иона противоположно заряжены и стремятся соединиться в молекулу. Эта реакция происходит с выделением тепла, и поэтому смесь растворов сама разогревается.
Образование воды из Н+ и ОН“ называют реакцией нейтрализации. Какова же судьба в этой реакции иона металла из щёлочи и отрицательного иона кислоты? Они тоже несут противоположные заряды, а это значит, что они соединяются друг с другом, образуя соль:
Na ЮН + Н] Cl — Н20 + NaCl,
Mg :(OH)^+H^ so4 — MgS04 + гн2о.
Поэтому реакция нейтрализации всегда даёт наряду с водой ещё и соль того или иного состава. Соли очень хорошо диссоциируют в растворе. Но они не одинаково хорошо в нём сохраняются. Устойчивость соли в растворе зависит от силы кислоты и силы щёлочи, образовавших её. Дело в том, что вода сама диссоциирует на водородный и гидроксильный ионы, хотя и очень слабо; из каждых 10 миллионов молекул воды только одна распадается на ионы. Но так как даже стакан воды содержит многие миллиарды миллиардов молекул, то и такая слабая диссоциация воды достаточна для того, чтобы ионы воды смогли образовать с ионами соли недиссоциированные молекулы кислоты или основания. Когда это может и когда не может произойти? Если соль получена из сильной кислоты и сильной щёлочи, то и соль, и кислота, и щёлочь одинаково хо-рошо диссоциируют и ионы воды на них не действуют. Так, ни поваренная соль, н^ селитра, ни сернокислый натрий в растворе не изменяются. Другое дело, если соль получена из кислоты и щёлочи не равной силы. Ионы воды тогда образуют с ионами соли недиссоциированные молекулы слабой кислоты или щёлочи. Это и наблюдается, например, в растворе уксуснокислого натрия:
СН3СОО'На+ + Н+ОН - + ОН - + СН3СООН.
Уксуснокислый натрий вода едкий натр уксусная кислота
Диссоциирован не диссоциирована
То же самое происходит в растворе соды, Ыа2СОз, так как она — соль очень слабой угольной кислоты (Н2СОз) и очень сильной щёлочи (ЫаОН). И уксуснокислый натрий и сода образуют щелочные растворы, хотя и не содержат в молекулах гидроксильных ионов. Наоборот, нашатырь (хлористый аммоний) образует кислые растворы, как и все другие соли сильных кислот и слабых щелочей.
Наши примеры показывают, что ионы воды могут вызывать реакцию разложения соли, прямо противоположную реакции нейтрализации. Эта обратимая реакция разложения солей водой называется реакцией гидролиза. Реакция гидролиза иногда очень полезна. Это показывает следующий пример.
Почему мыльная вода моет и стирает лучше, чем чистая? Хозяйственное и туалетное мыла — это натриевые соли так называемых «жирных» кислот. Обычное хозяйственное мыло — натриевая соль стеариновой кислоты. Стеариновая кислота — одна из самых слабых кислот, и
Поэтому её соли, в том числе и мыло, сильно гидролизуются:
Стеариновокислый + вода едкий + стеариновая
Натрий натр кислота
Образующийся едкий натр даёт с отмываемыми жировыми веществами растворимое в воде мыло. Таким образом одна из причин моющего действия мыла — его гидролиз. Вторая причина — особый характер растворов мыла. Растворы мыла, если они не очень разведённые, служат одним из примеров коллоидных растворов, отличных от истинных растворов, о которых мы до сих пор говорили. Коллоидные растворы содержат не отдельные молекулы растворённого вещества, а целые скопления связанных друг с другом и определённым образом расположенных молекул. Размеры таких коллоидных частиц — мицелл в сотни, а иногда в тысячи раз больше, чем размеры молекул в истинных растворах[24]). Многие коллоидные растворы, в том числе и мыло, способны давать пену. Пена «вбирает» в себя твёрдые частички грязи и капельки масла или жиров с поверхности предметов, подвергаемых мытью. Чистая вода не способна давать пену, и не может обладать такими же моющими свойствами, как мыльная. Но всё же моющие свойства мыла зависят и от применяемой воды.
Почему в жёсткой воде мыло плохо мылится? Лучше всего мыло мылится в чистой (дестиллированной) или в дождевой воде. Дождевая вода не содержит солей кальция или магния. Если же мы пользуемся жёсткой водой, то мыло свёртывается: оно вступает в реакцию двойного обмена с содержащимися в ней солями кальция и магния и образует нерастворимые в воде мыла:
Стеариновокислый натрий + сернокислый кальций —> сернокислый натрий + стеариновокислый кальций (нерастворимое мыло).
Эти мыла уже не способны давать ни пену, ни достаточно щелочную реакцию раствора.
При стирке обычно добавляют к воде соду. Сода увеличивает щёлочность раствора и тем самым облегчает отмывку жиров, удерживающих налипшие на ткань частички грязи или пыли.
|
И |
З недр земли добывают множество полезных ископаемых: руды, различные виды топлива (уголь, нефть, торф, горючие сланцы), глину, слюду и другие материалы, важные для современной техники и промышленности.
|
Руда, кокс, известняк и пр. |
![]()
|
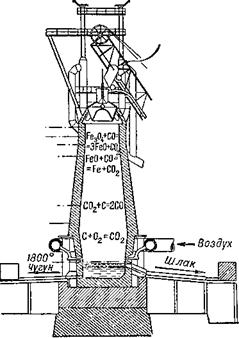
Рис. 12. Схема доменного процесса. |
![]()
 Особенно нужны для всех отраслей техники металлы. Но в недрах земли в свободном состоянии находят только наименее активные метал - %00о лы—серебро, ЗОЛО - 500° —
Особенно нужны для всех отраслей техники металлы. Но в недрах земли в свободном состоянии находят только наименее активные метал - %00о лы—серебро, ЗОЛО - 500° —
То, платину. Ос - 800°-------------
Тальные металлы обычно встречаются В горных поро - /000О
Дах в виде соеди - 0________
Нений с кислородом, серой и др.
Если металл находится в соединении, значит, он окислён. Выделить его можно только реакцией восстановления.
Познакомимся с получением из
Руд самого важного для промышленности металла — железа.
Что происходит в доменной печи? Для выплавки железа используют главным образом две железные руды: бурый железняк Ре20з и магнитный железняк Ре304. Эти руды восстанавливаются окисью углерода при высокой температуре в специальных доменных печах (рис. 12). Печь загружают сверху смесью руды, кокса и шлакообразующих материалов (глины, известняков, песка), а снизу в неё вдувают нагретый до высокой температуры воздух.
В нижней части печи, где приток воздуха достаточно велик, кокс сгорает, образуя углекислоту. Поднимаясь вверх, углекислота встречает на своём пути раскалённый кокс и вступает с ним в реакцию, образуя окись углерода:
С02 + С (кокс) = 2СО.
Окись углерода в свою очередь действует на окислы железа, отнимая у них кислород и восстанавливая их до металла:
Fe304 + СО — 3FeO + С02; FeO + СО — Fe + С02.
Магнитный закись закись железо
Железняк железа железа
По мере выгорания кокса вся масса в печи опускается вниз и попадает в зону более высокой температуры, где железо плавится и образуются шлаки.
Почему для выплавки чугуна берут кокс, а не каменный уголь? Для чего нужны глина, известняк, песок?
Каменный уголь содержит плавкие составные части, которые склеивают, «спаивают» отдельные его куски и этим затрудняют движение газов через смесь угля с рудой. Кокс же — это уголь, из которого нагреванием удалены все плавкие составные части. Поэтому куски кокса при горении не спаиваются и не затрудняют ни движение воздуха, ни стекание расплавленного металла в нижнюю часть домны, где температура особенно высока. Но ведь именно здесь и вдувается воздух, — почему же восстановленное из руды железо не окисляется опять, встречаясь с воздухом в нижней части печи? Вог эгому-то препятствуют шлаки — расплавленные сложные соединения, образуемые при высокой температуре песком, известью и глиной. Обволакивая капельки чугуна, шлаки защищают его от соприкосновения с воздухом. Скопляющиеся на дне печи чугун и шлак сами собой разделяются: более лёгкий шлак образует верхний, а более тяжёлый чугун — нижний слой расплавленной массы. Их выпускают из печи отдельно друг от друга.
Чугун — не чистое железо. Он содержит свыше 2,3 процента углерода в форме соединения — углеродистого железа, сообщающего чугуну хрупкость. Чугун не поддаётся ковке. Если из чугуна выжечь часть углерода, то получится сталь. Выжигание угля ведут в специальных печах — мартеновских, бессемеровских. Сталь содержит около 1,5 процента углерода. Ковкое железо содержит только около 0,5 процента углерода и тоже получается выжиганием углерода из чугуна. Добавляя к чугуну при его переплавке другие металлы — хром, никель, молибден и т. п., получают много сортов специальных сталей — с повышенной твёрдостью, прочностью, нержавеющие и т. д.
Чем отличаются друг от друга дрова, торф и каменный уголь? Кое-что нам скажет табличка, в которой приведены данные о составе и теплотворной способности (количестве тепла, получаемого при сжигании одного килограмма топлива) различных видов твёрдого топлива:
|
Топливо |
Содержится в процентах |
Теплотворная способность |
|||
|
Углерода |
Кисло Рода |
Водорода |
Азота |
||
|
Дерево (сухое) Торф................. Бурый уголь. Каменный уголь.... Антрацит. . . |
49,3—56 50—60 60—82 83—87 92—97 |
37,4—43 33-42 10-36 6—9 1,5—3 |
6,0—6,6 5,5-5,9 6,0-6,5 5,6 0,6—3,5 |
1,1-1,5 2,2 1,4 1,-5 0,8 |
3000—3500 3550 4000-6000 7000—7500 8500 |
Эта табличка показывает, что при переходе от дерева к антрациту содержание углерода увеличивается, содержание кислорода уменьшается, а содержание водорода и азота меняется не сильно. Эти различия не случайны: источником образования торфа и углей в природе являются отмершие растения, и разница между торфом и углями зависит от того, насколько далеко зашло разложение растительных остатков.
Древесная масса в основном состоит из сложных соединений — целлюлозы и лигнина, очень богатых кислородом (до 43 процентов). Оба эти вещества после гибели дерева разрушаются и дают разнообразные обогащённые углеродом продукты разложения. Из таблицы видно, что даже антрацит — наиболее древний из углей — не является чистым углеродом, а содержит ещё кислород, водород и азот. Поэтому считают, что угли — смеси углерода со сложными соединениями, очень богатыми углеродом и бедными водородом.
Каменные угли в природе образовались за тысяче« летия. В течение этого времени древесная масса разлагалась без доступа воздуха, при невысокой температуре и под давлением вышележащих пород.
Нефть. Нефть — жидкое топливо. Оно особенно удобно потому, что его можно использовать в двигателях внутреннего сгорания — моторах автомашин, самолётов и т. п. Нефть удобнее транспортировать, чем уголь. Но самое главное преимущество нефти перед твёрдым топливом заключается в том, что нефть почти целиком состоит из горючих составных частей — углеводородов; кислородных соединений в нефти очень мало, и золы она также оставляет немного. Поэтому теплотворная способность нефти очень велика — до 11 ООО килокалорий.
Нефтяные месторождения расположены в тех местах, где в древние геологические времена были моря. Это позволяет считать, что нефть образовалась в недрах земли, из останков морских животных и растений. Именно на дне морей могли накапливаться и разлагаться без доступа воздуха огромные количества останков животных и растений, постепенно покрываясь наносными отложениями. Блестящее подтверждение эта точка зрения получила в опытах академика Н. Д. Зелинского, получившего искусственную нефть из различных веществ, содержащихся в тканях животных и растений.
На нефтеперерабатывающих заводах производится перегонка нефти. При перегонке из нефти выделяют бензин (углеводороды нефти с температурой кипения не выше 200 градусов), керосин (углеводороды, кипящие при 200—300 градусах), а также лигроин, газойль. Из остатка нефти после отгонки бензина и керосина выделяют смазочные масла и вазелин. Вымораживая масляные погоны нефти, получают парафин. И бензин, и керосин, и нефтяные масла — сложные смеси различных углеводородов.
Нефть используется не только как топливо, нефть — важное сырьё для химической промышленности. Больше тысячи различных продуктов получают сейчас из нефти. Здесь и взрывчатые вещества, и различные красители для тканей, духи и лекарственные препараты, асфальт и пластмассы и т. п. [25]). В деле переработки нефти огромное
Значение имеют исследования русских и советских учёных: Д. И. Менделеева, В. В. Марковникова, Н. Д. Зелинского, В. Г. Шухова и многих других.
Как используют каменный уголь. Долгое время каменный уголь был только топливом, но в настоящее время он служит сырьём для целой отрасли нашего народного хозяйства — коксохимической промышленности. Коксохимическая промышленность использует продукты сухой перегонки каменного угля. Сухая перегонка угля производится в коксовых печах. Уже само их название показывает, что одним из главных продуктов перегонки угля является кокс. При перегонке образуются также светильный газ, каменноугольный дёготь и «подсмольная вода». Каменноугольный дёготь является важным источником сырья для получения различных органических соединений. В нём содержатся ценные продукты: бензол, нафталин, карболовая кислота и многие другие. В подсмоль- ной воде растворено много ценного газа аммиака, образующегося при разложении азотистых составных частей угля. Светильный газ — удобное топливо.
Круговорот углерода в природе. Горение топлива, дыхание и разложение углеродистых веществ — все эти процессы приводят к образованию углекислоты. При образовании каждой грамм-молекулы углекислоты (44 грамма) из углерода (12 граммов графита) и кислорода (32 грамма) выделяется 97 килокалорий тепла. Наукой установлено, что чем больше тепла выделяется при образовании соединения, тем оно прочнее, устойчивее. Именно потому, что углекислота образуется с очень большим выделением тепла, она химически мало активна — для разрушения её молекулы нужно затратить много тепла. Поэтому химическая переработка углекислоты невыгодна.
Казалось бы, образование С02 в природе должно вести к непрерывному уменьшению количества других, более активных углеродистых соединений на Земле. В организме человека за сутки сгорает в углекислоту около 100 граммов углерода, входящего в состав продуктов питания. В среднем человек живёт около 60 лет. Значит, только один человек за свою жизнь превращает в углекислоту свыше 2000 килограммов углерода органических соединений. А ведь население земного шара — около
2 миллиардов человек. Да кроме того питаются и дышат также и животные и растения. Значит, углекислота должна была бы накапливаться в природе за счёт разрушения органических соединений.
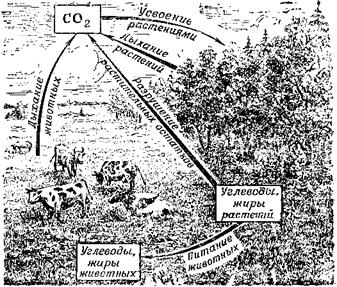
Однако этого не происходит. Углерод совершает в природе «круговорот»: процессы, идущие с образованием углекислоты, уравновешены процессами усвоения, ассимиляции углекислоты зелёными растениями (рис. 13). Растения питаются углекислотой, превращая её в углеводы и жиры. Ассимиляция углекислоты происходит,
|
Рис. 13. Круговорот углерода в природе. |
Только под влиянием зелёного красящего вещества — пигмента растений хлорофилла и солнечного света. Хлорофилл улавливает, концентрирует энергию света и передаёт её молекулам углекислоты. В результате молекулы углекислоты «расшатываются», становятся более способными к реакциям. Весь этот процесс назвали фотосинтезом. Его можно изобразить следующей схемой:
Солнечный свет
Углекислота + вода --------------- ------- > сахар + кислород.
Хлорофилл
Процесс усвоения углекислоты растениями изучил великий русский учёный К. И. Тимирязев.
Животные не могут усваивать углекислоту и пользуются для пополнения запаса органических соединений растительной пищей.
Усвоение углекислоты растениями предотвращает и вторую катастрофу — полное израсходование свободного кислорода в природе. Ведь во всех процессах образования углекислоты потребляется свободный кислород. Однако усваивая углекислоту, растения расщепляют её молекулу и выделяют свободный кислород — на каждый усвоенный ими атом углерода выделяется один атом свободного кислорода. Таким образом не только углерод, но и кислород совершает в природе «круговорот».