Зависимость константы диссоциации от степени полимеризации
Ниже рассматриваются константы диссоциации дикремневой и поликремневых кислот, коллоидных форм и гелей кремнезема в связи с их непосредственным отношением к процессу полимеризации монокремневой кислоты.
Беляков и др. [35] сообщили о возрастании кислотности кремневой кислоты при полимеризации. В процессе полимеризации мономера величину рКа определяли титрованием, а степень полимеризации — криоскопическим методом. Отмечалось, что максимальное значение р/С = 10,7 было зарегистрировано
для H2Si207, для полимеров є более высокой массой значение рКа падало до 6,5. Однако неизвестно, происходит ли такое понижение рКа в результате образования циклических соединений с группами =Si(OH)2 или же в результате образования трехмерных частиц с поверхностными группами = SiOH.
Наибольшее сомнение в указанном сообщении вызывает значение р/Са = 10,7 для дикремневой кислоты, поскольку это означало бы, что дикремневая кислота является более слабой ркъ по сравнению с монокремневой кислотой, для которой рДа = 9,8. По аналогии с другими неорганическими кислотами следовало бы предположить, что дикремневая кислота должна быть более сильной кислотой, чем мономер. К сожалению, димерную форму трудно или даже невозможно приготовить и сохранить в достаточно чистом виде для проведения обоснованных измерений. Тем не менее был приготовлен раствор, в котором, вероятно, по крайней мере 50 % всего кремнезема составлял димер [36].
В исследованиях, выполненных ионообменным методом, было показано [37, 38], что поликремневая кислота представляет собой более сильную кислоту, чем мономер Si (ОН) 4- Константы диссоциации кислотных центров на поверхности поликремневой кислоты по крайней мере на два-три порядка выше, чем константа диссоциации мономера. Даггер и др. [39а] методом измерения катионного обмена ионов 20 различных металлов оценили кислотность силанольных групп на поверхности кремнезема. Этим методом они показали, что когда первые атомы водорода покидают чистую силанольную поверхность кремнезема, константа диссоциации Ка должна иметь порядок 10~6—10~8. Эти значения показывают, что силанольные группы на поверхности кремнезема являются гораздо более кислыми, чем мономер Si (ОН) 4, ДЛЯ которого Ка — Ю-9'8.
|
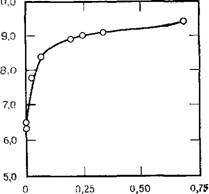
Степень нейтрализации Рис. 3.3. Зависимость рКа силанольных групп на поверхности аморфного кремнезема от степени нейтрализации (по данным [396].) |
Изменение рКа на поверхности кремнезема в зависимости от степени нейтрализации поверхности показано на рис. 3.3 [396]. Оно определено исследованием механизма ионного обмена ионов Na+, Cs+, Са2+, Sr2+ и Ва2+ на силикагеле, а также
на геле с использованием солей двух - и трехвалентных металлов.
Даффи и Ингрем [39в] сумели оценить константы диссоциации большого числа кислот на основании имеющихся данных по электроотрицательностям составляющих элементов, а также по льюисовской основности или по «оптическим основаниям», полученным из спектроскопических данных. Хотя такие методы и нельзя применить к монокремневой кислоте, для поликремневых кислот полезные данные были получены [39г].
Аллеи, Матиевич и Мейтес [39д] предложили уравнение, связывающее степень'замещения поверхностных атомов на частицах коллоидного кремнезема с величиной рН раствора. Они показали, что для полностью водородной формы поверхности рКа составляет 6,4, а для полностью натриевой формы р/Са=9,6.
Шиндлер и Камбер [40] исследовали кислотность силанольных групп на поверхности кремнезема или поликремневой кислоты. Они подсчитали истинную константу кислотности Kint на основании результатов, полученных при титровании геля кремнезема в 0,1 М растворе NaC104 при 25°С:
Lg Кш = —6,8 ± 0,2
Для процесса
= SiOH = = SiO" + H+ имеем lg К — lg [Н+] + lg •
Где а — степень нейтрализации или доля силанольных групп на поверхности, способных ионизироваться при данном значении рН.
Истинная константа кислотности Kint равна, по определению авторов, константе К при а-»-0. Из этих данных выведено следующее уравнение:
1 а к \аК 1.9 (а + а2) lg А = \gKint — 0,039 + а
Где lg Kint = —6,81. Тогда
Чтобы это уравнение было правомерным, необходимо принять во внимание имеющиеся в растворе в равновесии силикат - ионы. Билинский и Ингри [34а] рассчитали значения констант диссоциации для различных силикат-ионов в 0,5 М растворе NaClOi при 25°С. Для процесса
SiO, (аморфн.) + 2Н20 = Si (ОН)4
Предполагается, что растворимость силикагеля составляет 0,012 %.
JH+) [(НО)з SiO-] __ jq-9,46_ д-*
[Si (ОН)!]
[Н+] [(H0)2Si02 , _1n_,2>S6
[(НО)з SiO"] [H+]2[(H0)sSi4026-
[Si (ОН)4І
[H+][OH""]=10-13'8=/Cffi,
Суммарная обменная емкость С, определяемая как максимальное число групп, способных ионизироваться при данных условиях титрования, оказалась равной 2,43 групп ОН/нм2 в 0,1 н. растворе NaC104. Авторы также приводят значения С при других концентрациях: 3,4 групп ОН/нм2 в 1 М NaC104 и 5,83 групп ОН/нм2 в З М NaC104.
Рассмотренный подход при определении кислотности поверхности кремнезема совершенно отличен от подхода [41, 5], при котором видоизменено стандартное уравнение, применяемое к органическим поликислотам:
РН = рК - fe, lg aN - k2 lg - l) (1)
Где R — отношение молярных концентраций CSiQ /CNaj0 (Na20 — титрант);
A—удельная поверхность кремнезема, м2/г; а и N— активность и нормальность соли натрия в системе.
На основании данных Болта [42] были определены константы в уравнении: рК = 12,08, ^ = 0,74, k2 = 3,47 и £3 = 2430.
В этом уравнении нет допущения, принятого выше в отношении доли силанольных групп, способных к ионизации. Однако число зарядов, приходящееся на единичную площадь поверхности, может быть подсчитано из величин С 0 и Л. В качестве
Примера можно рассмотреть какую-либо точку на кривой Шннд - лера и Камбера для образца силикагеля с удельной поверхностью 372 м2/г. При выбранном значении а = 0,1 было получено lgi<C = —8,3 и по уравнению Шиндлера и Камбера рассчитано рН 7,35.
Из уравнения (1) при известных рН 7,35 и Л = 372 м2/г было определено значение R, оказавшееся, равным 240 Si02: Ха20. Таким образом, для 60-240 г SiO; имеется 2-6Л 023 противо - ионов Na+ и ионизированных групп ОН. Далее лодсчитывается число ионизированных мест на поверхности, приходящееся на 1 нм2:
12 • 10» ; 0>22
60 • 240 • 372 ■ 1013
Согласно Шиндлеру, имеется 2,43 способных к ионизации групп ОН в расчете на 1 нм2. Следовательно, степень нейтрализации а = 0,22/2,43 = 0,09. Эта величина очень близка к значению 0,10 для первоначально выбранной точки в рассматриваемом примере. Другими словами, оба указанных приближения, по-видимому, дают сходные результаты.
Было также показано совершенно другим методом, что константа кислотной диссоциации групп ОН на поверхности полимерного кремнезема составляет около Ю-7,1. Был измерен [43] сдвиг частот ИК-полос поглощения гидроксильных групп фенола, адсорбированного на поверхности кремнезема, и сравнен со сдвигами частот в присутствии спиртов с известными константами кислотности. Маршалл и др. [44] на основание подобных исследований пришли к заключению, что значение рКа для части групп SiOH на поверхности кремнезема может составлять ~7,2.