Хром
Особенности хрома выявляются при сравнении его с алюминием. Ионы А134" и Сг3+ имеют большое сходство с точки зрения их поведения при осаждении в виде гидроксидов, однако они сильно различаются при взаимодействии с кремнеземом. Одна из причин заключается в том, что хромит-ион не образуется столь же легко, как А10~. Ион Сг3+ значительно больше по
Размеру, чем А13+, и поэтому не может входить в решетку Si02 с образованием стабильных анионов, как это имеет место в случае алюминия, когда образуются ионы (SiA104)_.
Таким образом, ионы Сг3+ проявляют специфическую инертность по отношению к мономерному кремнезему, заметно отличаясь по поведению от ионов А13+. При нагревании аморфного кремнезема со смесью Cr(OH)s и А1(ОН)3 под давлением при температуре 300°С в течение 2 суток только оксид алюминия присоединялся к кремнезему [63]. Таким поведением хрома, вероятно, объясняется очень малая распространенность силикатных минералов хрома в природе.
Согласно Айлеру [50], шестивалентный хром в виде Н2Сг04, по-видимому, образует комплекс с мономером Si(OH)4- Хромат-ион отличается от других неорганических анионов тем, что замедляет процесс полимеризации Si(OH)4 в области рН 0,5— 3,0. При рН 1,7, когда мономер Si(OH)4 наиболее стабилен, наблюдалось линейное возрастание времени гелеобразования од - номолярной суспензии золя кремнезема в зависимости от молярного отношения СгОз: S1O2. Время менялось от 69 ч в отсутствие СгОз до 270 ч при отношении СгОз: S(02 0,75, а затем оставалось постоянным при более высоких отношениях. Это время (270 ч) соответствует времени гелеобразования в 0,5 М суспензии золя Si02 в отсутствие Н2Сг04.
Таким образом, подобная система ведет себя так, как если бы хромовая кислота Н2Сг04 количественно димернзовала кремнезем, а избыток Н2Сг04 не оказывал бы дальнейшего действия:
0 — H--Q—н—о
1 К!
НО—Si—О—Сг—О—Si - он, І і!
© Н 1 > н о
По-видимому, этот «димер» затем превращается в гель с такой же скоростью, как и раствор с концентрацией кремнезема, равной лишь половине исходной. К сожалению, полученный гель не был исследован, для того чтобы убедиться, действительно ли ион Сг02~ связан в подобную структуру.
Никаких сообщений о таком соединении, как хромат кремния, не имеется, но вполне очевидно, что кремний может связываться с хромом (VI) через кислород силанольной группы. Шмидт и Шмидбаур [64] приготовили сложный триметилси - лильный эфир хромовой кислоты:
О
(СНз)з SiOCrOSi (СНз)з О
Алюминий
|
|
|
Рн |
В других главах уже обсуждался вопрос, связанный с действием ионов алюминия, и отмечалось специфическое сродство между оксидами алюминия и кремния. С такой позиции отме-
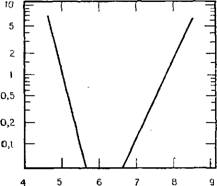
Рис. 3.7. Зависимость растворимости оксида алюминия в воде от рН (по данным [65]).
Тим лишь несколько экспериментальных наблюдений, относящихся к взаимодействию А13+ с мономером Si(OH)4.
Как доказано ранними исследованиями Окура, Гото и Му - раи [65] (рис. 3.7), оксид алюминия значительно менее растворим в воде, чем кремнезем, в интервале рН 5—8 при 25°С.
Согласно Гото [66], мономерный кремнезем вступает в реакцию с ионами А13+ и наиболее эффективно осаждается при рН 9. Так, если к исходному раствору кремнезема с содержанием 0,0035 % Si02 добавлялось 0,002—0,01 % алюминия в виде ионов А13+, то это приводило к снижению концентрации кремнезема
в растворе до такого значения С, когда ЛС = 300 (Л и С — концентрации А1э+ и S1O2 соответственно в весовых частях на миллион частей раствора). Однако такое состояние, вероятно, не представляло истинного равновесия.
Если реакция мономерного кремнезема Si(OH)4 с ионами А13+ протекает в течение длительного времени при 25°С, то образуется силикат алюминия в коллоидной форме с составом галлоизита:
2Si (ОН)4 + 2А13+ + H20 = Al2Si205 (OHJ4 + 6H+
Хем и др. [67] проводили реакцию между кремнеземом и оксидом алюминия при различных рН в течение периодов времени вплоть до 4 лет и измеряли оставшиеся в растворе концентрации Si(OH)4 и'А13+. Таким путем были определены следующие константы:
[AI3+][Si(OH)4l2 =1qI1,2, при 250С
[А1 (ОН)Г]2 [Si (ОН)4]2 [Н+]2 = 10~32'9?
Значение стандартной свободной энергии коллоидного силиката алюминия составило —897+ 1 ккал/моль.
Мономерный кремнезем сильно адсорбируется на поверхности гидроксида алюминия. В результате реакции между Si(OH)4 и А1(ОН)3 на поверхности последнего образуется несколько слоев вступившего в реакцию кремнезема и наблюдается в то же время понижение рН суспензии [68а]. Образование первого слоя происходит быстро, но второй и третий слои застраиваются гораздо медленнее. Вероятно, с поверхности кристалла должна происходить диффузия ионов А13+ или АЮг~ с образованием обогащенного кремнеземом алюмосиликата. Относительно небольшое содержание ионов алюминия в слое кремнезема тем не менее заметно понижает растворимость та кого слоя. Этим объясняется осаждение S1O2 из раствора, не насыщенного по отношению к чистому аморфному кремнезему.
Бауман [686] нашел, что при добавлении к раствору мономерного кремнезема (0,042 % Si02) различных количеств ионов алюминия относительно большая доля кремнезема вступала в реакцию с молибдатным реактивом, чем в отсутствие алюминия. Так, когда алюминий не добавлялся, через 4 сут 0,013 % кремнезема в виде мономера вступало в реакцию с молибдатным реактивом, а 0,029 % оставалось в равновесном состоянии в растворе в виде относительно неактивного высокополимера. Но в присутствии алюминия при отношении А1 : Si, равном 1 : 7, в реакцию с молибдатом вступало около 0,02 % кремнезема. Это можно объяснить тем, что оксид алюминия присоединялся к кремнезему, образуя алюмосиликат. Такой алюмосиликат затем распадался под действием сильнокислого молибдатного реактива, дополнительно выделяя активный кремнезем в виде мономера.
Однако когда концентрация кремнезема составляла лишь 0,006 %, т. е. была ниже растворимости аморфного кремнезема, никакой полимеризации не происходило, за исключением случаев, когда добавляли оксид алюминия. При отношениях Al : Si от 1:1 до 1:10 ионы алюминия переносятся вместе с мономером, образуя обогащенный кремнеземом комплекс, в котором некоторое количество кремнезема к тому же связывается в такую форму, которая менее реакционноспособна по отношению к молибдату. Обширные данные Баумана заслуживают более детального изучения.
Конечным продуктом реакции на поверхности оксида алюминия является галлоизит. Когда разбавленный раствор мономерного кремнезема вступал в контакт с у-АЬОз, то мономер Si (ОН) 4 адсорбировался со скоростью, зависящей в сильной степени от рН и величины поверхности оксида алюминия А. Обнаружено, что в среде с постоянной ионной силой (0,1 н. раствор NaCl) и при концентрациях кремнезема 10~3—10^4 М начальный этап адсорбции протекает быстро [69а]. При рН<9 скорость пропорциональна произведению Л2 [SiOz]1-5 [Н+]"-°>5, но при рН>9 она пропорциональна Л2 [БіОг]1-5 [Н+]. Хуанг предположил, что основной реакционноспособной разновидностью являются ионы HSiO-.
Возможно, что в присутствии четвертичного аммониевого основания, но в отсутствие катионов металлов в растворе могут оставаться анионы алюмосиликата, например (HO)3SiOAl(OH)2OSi(OH)- . Флениген [696] сообщил, что четвертичные аммониевые силикат и алюминат оставались в растворе до тех пор, пока не добавлялась натриевая соль.
Айлер при использовании чистого а-А1203 не обнаружил никакого его взаимодействия с мономериым кремнеземом. а-А1203 в коллоидной форме, свободный от других форм оксида алюминия и от ионов А13+, приготовлялся следующим образом. Частицы исходного а-А1203 обрабатывали 24 %-ным раствором HF в течение 24 ч с целью удаления всех примесей оксидов алюминия и кремнезема, промывали водой и затем гидроксидом аммония NH4OH для удаления всех ионов F - с поверхности оксида алюминия [70а]. При рН 7—8 не наблюдалось ни адсорбции моиомерного кремнезема, ни вступления его в реакцию с данной формой оксида алюминия, несмотря на то что удельная поверхность оксида алюминия составляла 24 м2/г. По-видимому, для реакции с мономером Si(OH)4 требуется присутствие ионов А13+ или многоосновных ионов алюминия.