Водные растворы, неионные системы, водородная связь
Как обсуждалось в гл. З в связи с образованием растворимых, а в некоторых случаях и нерастворимых комплексов, связанных водородными связями с поликремневой кислотой, может иметь место взаимодействие нейтральных полярных органических молекул, в состав которых входят атомы кислорода или азота, обладающие свободными электронными парами. Точно такие же типы связей участвуют в адсорбции из воды на границе раздела фаз вода—силанольная поверхность.
Как детально рассматривалось в гл. 4 (см. лит. к гл. 4 [162— 191]), при значении рН выше нейтрального на поверхности кремнезема создается возрастающая концентрация отрицательных зарядов и образование водородной связи около таких заряженных центров предотвращается. При этом нет никакого различия, является ли таким заряженным центром поверхностный ион SiO - или же это будет алюмосиликатный анион AlSiO~. Про-
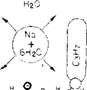
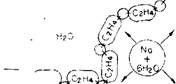
Тивоион, обычно катион Ыа(НгО)+, остается вблизи такого заряженного центра и мешает приблизиться к поверхности молекулы адсорбируемого вещества (рис. 6.8).
|
! |
С другой стороны, при низком значении рН, когда на поверхности имеется лишь очень незначительный заряд, силанольная поверхность может покрываться монослоем молекул воды, связанных с поверхностью водородными связями. Если в системе присутствуют водорастворимые полярные органические моле
кулы, то они конкурируют с водой за выход к силанольной поверхности.
Донахью и Бартелл [182] изучили адсорбцию воды из водно-спиртовых смесей («-бутил, гексил и гептил) на силикагеле с удельной поверхностью 455 м2/г и диаметром глобул 8—9 нм. Авторы пришли к заключению, что полярные гидроксильные группы на конце молекулы спирта притягиваются к поверхности кремнезема, но эти молекулы вытесняются водой, если концентрация воды в спирте увеличивается. По-видимому, вода адсорбируется в капиллярах, при этом образуется обогащенная водой фаза. При исследовании адсорбции «-бутанола было определено, что площадь, занимаемая одной молекулой, составляет 39,6 А2 при 25°С и 33,8 А2 при 45°С. Авторы сравнивают эти величины с площадью 21,6 А2, подсчитанной на основании молекулярных размеров. Отсюда следует, что молекулы спирта в данном случае не столь плотно упакованы на поверхности кремнезема, как это имеет место в жидких мономолекулярных слоях высших спиртов на поверхности жидкой воды.
|
"СгН^ХСгНц. ^ Xі ДіУ й. * О - п п Oojoo_oooooo^o Si02 |
|
|
|
^ОООООООО:- SiOz Рис. 6.8. Схема уменьшения числа водородных связей между молекулой адсорбируемого вещества и поверхностью кремнезема около заряженных участков поверхности. Большой по размеру гидратированный и он натрия при своем перемещении над заряженным участком поверхности препятствует присоединению молекул адсорбата (например, полиэти - леноксида и изопропилового спирта), способных образовывать водородные связи с поверхностью. |
Для амидов остается невыясненным вопрос, будет ли водородная связь с поверхностью образовываться через атом азота или же в ее образовании участвует атом кислорода, как это, например, имеет место для диметилацетамида
|
SijOH: N - СНЧ |
|
Сн, |
|
С—СН3 Si50H:0 = C |
|
Нехтшейн [183] утверждает, что по крайней мере в присутствии только изолированных, свободных групп SiOH на частично |
N(CH3)2
Дегидратированной поверхности кремнезема с силанольной группой SiOH взаимодействует именно группа СО.
Степень вытеснения одной органической молекулы другой с поверхности кремнезема может быть измерена. Экспериментально наблюдаемые факторы, которые упоминаются здесь, описаны в гл. 3, а относительные «эффективности образования водородных связей» различных классов соединений были, представлены в табл. 3.11. По-видимому, основными являются три фактора:
1. Прочность водородной связи. Как упоминалось в предыдущем разделе, измерения, выполненные Кертойзом и др. [87], показывают, что более прочные водородные связи образуются с более слабыми основаниями, такими, например, как пиридин, через атом азота и более слабые — через атомы кислорода простого эфира или кетогрупп, имеющих определенное сходство.
2. Соотношение числа углеводородных груНп к числу полярных атомов в молекуле. Это. отношение непосредственно связано с тенденцией углеводородных групп или цепочечных сегментов к освобождению от воды и концентрированию на поверхности раздела. Это еще один аспект поверхностной активности.
3. Число электроиодонорных атомов, приходящихся на одну молекулу адсорбата, т. е. число точек присоединения молекулы к поверхности (см. гл. 3).
Известно значительное количество публикаций, касающихся адсорбции азотных оснований из водных растворов, но, как правило, эти данные рассматриваются с точки зрения ионизированных аммониевых форм. Из-за наличия сильной конкуренции со стороны воды лишь немногие полярные соединения с низкой молекулярной массой способны сильно адсорбироваться на поверхности кремнезема (полимеры, образующие большое число связей с поверхностью, будут рассмотрены в следующем разделе).
Адсорбция из растворов сильных солей. Как было описано в гл. 3, вещества с низкой молекулярной массой, образующие водородные связи и обладающие лишь одним или двумя элек - тронодонорными атомами в расчете на одну молекулу, взаимодействуют с группами SiOH только в том случае, когда добавляется хорошо растворимая соль (NaCl пли Na2S04). Вероятно, она понижает концентрацию воды путем образования гидратных ионов; так, например, в 30 %-ном растворе NaCl две трети всей воды присутствует в системе в виде ионов Na(H20)+.
По-видимому, необходимо провести некоторые дополнительные исследования адсорбции на кремнеземе водорастворимых органических соединений с низкой молекулярной массой из относительно концентрированных солевых растворов при рН 2—4, когда может происходить образование водородных связей. Исследования, выполненные до настоящего времени, затрагивали только процессы осаждения или фазового разделения поликремневой кислоты или коллоидного кремнезема для определения полноты покрытия поверхности адсорбатом. Имеется некоторая неясность относительно того, что разные неорганические соли оказывают различное воздействие, возможно зависящее от степени их гидратации. Ничего не известно также относительно действия, оказываемого различными анионами.
Вероятно, исследованиям в этой области уделялось недостаточное внимание из-за того, что не было очевидных практических приложений, хотя, как это было впервые открыто Кирком (см. лит. в гл. 3 [162]), комплексы кремневой кислоты с водородными связями пригодны для дубления кож.