Работы Кудюрье, Бодру и Донне
Кудюрье, Бодру и Донне [36] провели обширное исследование полимеризации «дикремневой» кислоты в растворе, рН которого близок к нейтральному. В результате удаления ионов Na+ из Na2Si03 ■ 9Н20 в растворе при рН 2 авторы получили более 50 % смеси димера с мономером. Поскольку обе разновидности реагировали очень быстро с молибденовой кислотой, то их объединили под общим названием «мономер».
Было показано, что ниже рН 5—6 кремневая кислота вначале полимернзуется до дискретных частиц размером менее чем 4 нм (молекулярная масса частицы менее 50 000), а затем, если концентрация кремнезема еще достаточно высока, такие частицы агрегируют, образуя цепочки. Эти цепочки разветвляются в трехмерные сетки, каждая из которых представляет собой «полимерную» молекулу со значительно более высокой молекулярной массой, как показывают данные по рассеянию света. Очевидно, все эти дискретные частицы объединяются в сетки, которые в конце концов заполняют водную среду, формируя гель.
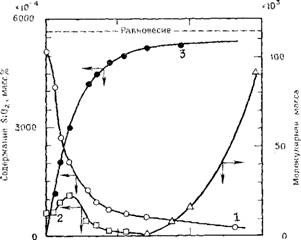
Раствор, содержащий только 0,6 % Si02, быстро полимери - зуется до дискретных частиц до того, как последние начинают агрегировать (рис. 3.50). Концентрация «мономера» быстро понижается, и обнаруживаются возрастающие количества оли - гомеров, а затем и полимеров с более высокими молекулярными массами. Далее содержание олигомеров понижается по мере того, как полимеры превращаются в коллоидные частицы. Размер таких коллоидных частиц должен быть менее 4 нм, как это следует из данных о концентрации мономера при равновесной растворимости. Коллоидные частицы после этого очень медленно увеличиваются в размере, что доказывается небольшим понижением их равновесной растворимости, определяемым измерением концентрации мономера.
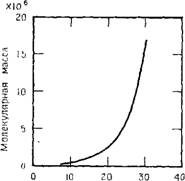
Повышение молекулярной массы, определяемой по рассеянию света, полностью обусловлено агрегацией сформировавшихся первичных коллоидных частиц Si02 в сетки (рис. 3.51).
Донне и соавторы изучили несколько ранних стадий процесса полимеризации и классифицировали соответствующие полимеры как олигомеры. Как показано в табл. 3.9, рассматриваемые реакции представляют собой только некоторые из возможных путей, по которым происходит образование олигомеров. Олигомер-1, который включает в себя и циклический тетрамер, имеет настолько низкую молекулярную массу, что способен еще деполимеризоваться и вступать в реакцию с молибденовой кислотой с относительно высокой скоростью. Олигомер-2 с более высокой молекулярной массой способен деполимеризоваться до мономера очень медленно, причем скорость процесса деполимеризации понижается с возрастанием молекулярной массы (размера частицы).
Действие величины рН на относительную скорость убывания мономера и на образование высокополимера представлено на рис. 3.52 и 3.53.
Начальное исчезновение димера при рН~2 является следствием самоконденсации димера. Авторы обнаружили, что в этом случае реакция представляет собой реакцию «второго порядка», для которой функциональная зависимость обратной концентрации непрореагировавшего «мономера» от времени
|
0 5 10 15 Время, ч Рис. 3.50. Зависимость количественного соотношения мономерной, олигомер - ной и коллоидных разновидностей кремнезема от времени полимеризации (по Данным [36]). |
|
Начальная концентрация мономера 0,6 масс. % Si02, рН 5, температура 20 °С. / — «мономер»; 2 — олигомер; 3 — иолнмер (илн кремнезем, не вступивший в реакцию с молибдатом).
Время, ч Рис. 3.51. Зависимость молекулярной массы полимера, определенной методом рассеяния света, от времени полимеризации (по данным [36]). Начальная концентрация мономера 0,6 масс. % SiCb, рН 5. |
|
Таблица 3.9 Разновидности олигомеров, образующихся на разных стадиях полимеризации кремневой кислоты при рН 1—5 (по данным Кудюрье, Бодру, Донне [36])
|
Линейна. С другой стороны, при рН 7,2 такая реакция является реакцией «первого порядка», когда «мономер» при добавлении к полимерным частицам формируется почти мгновенно после возрастания значения рН. В этом случае график указанной зависимости будет линейным с отрицательным наклоном.
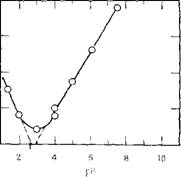
Из полученных кривых следует, что скорость исчезновения «мономера» и скорость появления полимера уменьшаются с изменением рН от 1,2 до ~3, а затем увеличиваются при возрастании рН до 5 и 7.
Таким образом, имеется два совершенно различных механизма, объясняющих превращение мономера в полимер. Ион водорода должен являться катализатором в этой системе при рН <3, хотя при более высокой концентрации кремнезема такое утверждение справедливо при рН <2. Выше рН 3 катализатором для процесса присоединения мономера или димера к растущему полимеру будет уже ион ОН~. Такое присоединение, как предполагается, имеет место, поскольку частицы олиго - мера-2 имеют на поверхности группы SiOH более кислые и,
|
К О Et |
|
0,1 |
|
100 |
|
Емя, ч |
|
Рис. 3.52. Зависимость процесса полимеризации от рН при концентрации 0,6 % Si02 (по данным [36]). ЛІ — «мономер»; Р — полимер. |
Следовательно, более ионизированные, чем подобные группы мономера или димера. Таким образом, мономер и димер вступают в реакцию конденсации с указанными поверхностными группами SiOH более быстро, чем с разновидностями, имеющими более низкую молекулярную массу.
Суммарная скорость исчезновения разновидностей мономер—димер (М) показывает, что они вступают в реакцию одновременно как между собой и с оли- гомером-1 (0(), так и с оли-
Гомером-2, который позже был обозначен как Sp (полимери - зованный кремнезем). При рН 4 было найдено, что такая суммарная скорость Нравна
V = К [M]U4 ехр (0,135 [О, + Sp])
|
1000 |
|
Рис. 3.53. Зависимость начальной скорости исчезновения мономера V от рН при концентрации 0,6 % Si02 (по данным [36]). |
Было измерено также влияние температуры на скорость исчезновения димера. В приведенном уравнении только константа К изменялась с температурой. Для процесса поликонденсации энергия активации равна 14,6 ккал/моль при рН 4.
Агрегация частиц кремнезема, названных олигомером-2 или Sp, начинается примерно тогда, когда мономер или димер большей частью уже израсходованы, а олигомера-1 остается лишь очень немного (рис. 3.52). Скорость такой агрегации для
Меризации (по данным [36].)
РН Температура, °С г/л SiO^
4 35 16
4 50 6
|
|
|
10 |
|
Я я П; Ь > 10 |
|
40 |
|
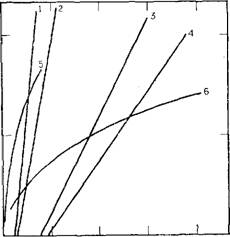
О 10 20 30 Время старения, мин Рис. 3.54. Зависимость молекулярной массы полимера от времени поли- |
|
10 |
|
Кривая І 1 3 4 5 6 |
5 20 16 4 35 6 6,3 20 6 7 20 6
Какого-либо одного изучаемого образца в области рН 1—6 подчиняется уравнению
|
In- |
ЛС
'■К J
М о
Где Мш — молекулярная масса агрегатов в момент времени t; М0 — начальная молекулярная масса дискретных частиц. Размеры и число дискретных частиц остаются постоянными для любого данного образца при рН<6.
Как показано на рис. 3.54, линейная зависимость наблюдается во всех случаях, за исключением рН>6, когда частицы, как известно, растут путем «созревания по Оствальду». К тому же выше этого значения рН на частицах начинает накапливаться возрастающий ионный заряд, достаточный по величине, чтобы предотвратить столкновение и агрегацию частиц. В таком
случае повышение молекулярной массы при более высоких значениях рН определяется увеличением размеров частиц, так как никакой агрегационной полимеризации не происходит. Кривая при рН 6,3 на рис. 3.54 представляет собой переходную область, когда происходят как агрегация, так и рост частиц.
Дополнительный интерес вызывают кривые 1 и 4 (рис. 3.54), полученные при одном и том же рН и различающиеся между собой только концентрацией кремнезема. Наклон прямой, выражающий скорость увеличения молекулярной массы, пропорционален корню квадратному из концентрации кремнезема и, следовательно, пропорционален корню квадратному из числа частиц в единице объема.
Донне и соавторы, применяя метод поляризации света, провели исследование растворов на той стадии полимеризации, когда уже мономер и димер были в значительной степени израсходованы. Исследование показало, что при рН 5—6 полимер состоял из чрезвычайно малых сферических частиц, тогда как при рН<5 такой полимер был, очевидно, более анизотропным. Этот факт, вероятно, может быть объяснен тем, что частицы начали связываться вместе в цепочки.
Как обычно, скорость процесса агрегации связывается с суммарной концентрацией кремнезема следующим образом:
^-==/CMte,[Si02]1'6
Полный температурный коэффициент показал, что энергия активации для процесса агрегации частиц при рН 4 равнялась 15,1 ккал/моль.
|
1200 |
|
800 |
|
600 |
|
2 400 |
|
200 |
|
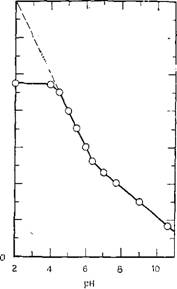
Рис. 3.55. Зависимость удельной поверхности геля кремнезема от рН (по данным [36]). |
|
Пунктирная линия: вероятные значения удельной поверхности, которые могли бы получиться, если бы при измерениях учитывались также наименьшие по размеру полимерные разновидности. |
Из ряда полимеризованных золей авторами были выделены и охарактеризованы гели, удельные поверхности которых, найденные по адсорбции азота, сопоставлялись при различных значениях рН, наблюдавшихся при приготовлении гелей (рис. 3.55).
Но, как известно, гели, имеющие величину удельной поверхности выше 800 м2/г, в процессе их высушивания дают усадку. Это приводит к тому, что поры становятся слишком тонкими и не впускают полностью молекулы азота, исключая возможность определения всей поверхности.
Известно также, что такая величина удельной поверхности геля оказывается лишь немного меньшей по сравнению с поверхностью первичных частиц, из которых гель состоит. Так, удельная поверхность 800 м2/г кремнезема, приготовленного при рН 5, соответствует первичным сферическим частицам с диаметром около 3,5 нм. Экстраполяция до рН 4 дает диаметр частиц приблизительно 2,3 нм. Как будет видно из работ других исследователей, такое значение близко к размеру частиц, приготовленных аналогичным образом, но охарактеризованных другими способами.