Органические катионы и основания
Механизм адсорбции органических оснований на кремнеземной поверхности изменяется в зависимости от силы основания и значения рН раствора. Адсорбция аминов при нейтральном рН может протекать посредством образования водородных связей с поверхностью кремнезема:
Si/)H - j - NR3 = Sij-OH : NR3
Амины с длинными цепями могут адсорбироваться в виде ионов аммония при условии достаточно высокого значения рН, чтобы образовался отрицательный заряд на поверхности кремнезема:
Si, OH + RNH2 = Si, OH3NR
Определяющим фактором для подобного рода покрытий является размер и тип углеводородной группы. Если R представляет собой длинноцепочечную алифатическую углеводородную группу, то такие поверхностно-активные группы стабилизируются за счет образования гидрофобных связей между ними на поверхности. При очень низкой концентрации вещества в растворе на поверхности адсорбируется только одиночный слой, и поверхность становится гидрофобной. Однако при более высокой концентрации, даже ниже критической концентрации ми - целлообразования, на поверхности формируется двойной слой (рис. 6.11). На рис. 6.11 показана схема адсорбции длинноцепо - чечных аминов на кремнеземе, например ацетата додециламнна, причем при рН 7 ниже 25°С, по-видимому, имеет место «физическая» адсорбция, скорее всего вследствие образования водородных связей. Выше 25 °С, согласно данным Болла и Фурсте - нау [324], идет процесс хемосорбции (вероятно, ионных форм). Такая адсорбция вызывает появление больших энтропийных эффектов, свидетельствующих об образовании гидрофобных связей между адсорбированными додецилгрунпами, что ведет к стабилизации всего адсорбированного слоя.
Элтон [325] описал изменение величины краевого угла при смачивании водой поверхности кремнезема по мере возрастания концентрации катионного ПАВ. Для случая БЦТМА (бромида
цетилтриметиламмония) наблюдения привели к следующим результатам:
Концентрация БЦТМА, Краевой угол, град моль/л
TOC \o "1-3" \h \z О о
10-7 84
10-6 90
Ю-4 90
2 • Ю-4 68
5 • Ю-4 51
|
|
|
Рис. 6.11. Схема адсорбции мицеллы четвертичного аммониевого катиона С длинной цепью. |
10-з 0
Н, о
Мицелла, адсорбированная на поверхности, вырастает в размере за счет мицелл из раствора. (По данным Айлера [3], с разрешения Cornell University Press.) '
Так как критическая концентрация мицеллообразования (к. к. м.) для БЦТМА равна 8,5-Ю-4, то ясно, что, если концентрация БЦТМА заметно ниже к. к. м., на поверхности образуется гидрофобный монослой с краевым углом 90°, но при концентрации БЦТМА, равной и выше к. к. м., формируется уже бимолекулярный слой и, следовательно, краевой угол снова падает до нуля. Ниже к. к. м., по мере того как кремнеземная поверхность превращается в гидрофобную, содержание БЦТМА в очень разбавленном растворе истощается и раствор становится прозрачным. Происходящие в такой системе изменения на молекулярном уровне были подробно описаны Тер-Минасян-Шарагой [326], который наблюдал, как большая доля осаждаемого углеводородного покрытия образовывалась из вещества, которое
концентрировалось на поверхности границы раздела фаз воздух—вода.
|
Катион |
Бреслер и соавторы [327] представили интересные сведения о нанесении покрытий на пористое стекло при использовании нескольких различных типов четвертичных аммониевых ионов. Ниже представлены полученные ими данные, выраженные авторами в микромолях в расчете на I г пористого стекла, имевшего удельную поверхность 18 м2/г и диаметр пор 1120 А, пересчитанные на, число молекул адсорбированного вещества, приходящееся на 1 нм2 (средние значения):
Число молекул при
Я-Ci6H33N (СНз)з C6H5N (С2Н5)з C6H5N (СНз)2СН2СбН5 рН 3 рН 6 рН 9
TOC \o "1-3" \h \z 0,8 1,3 1,9
О 0,15 0,5
0 0,3 0,7
Адсорбция в области рН 3—6 длинноцепочечных катионов показывает важное значение гидрофобных связей, которые заметно ослабляются при укорачивании длины цепи молекул. В этой области рН добавление диоксана, который ведет себя как ПАВ, «смачивающее» гидрофобные цепи и разрушающее гидрофильные связи, понижает адсорбцию всех указанных ионов до нуля. При рН 9 ионное притяжение является основной силой, обусловливающей адсорбцию, и поэтому адсорбция ионов еще происходит.
При повышении концентрации электролита происходит увеличение заряда на поверхности кремнезема, что в свою очередь вызывает возрастание адсорбции алкильных четвертичных аммониевых ионов с длинными цепями, как, например, цетилпири - дина [328]. Теплота адсорбции в подобных - системах примерно равна нулю, а энтропия адсорбции обусловливается ориентацией длинных углеводородных цепей-, расположенных в хемосорбиро - ванной пленке [329]. Площадь поверхности, занимаемая одним длинноцепочечным четвертичным аммониевым ионом С1бНззЫ(СНз)+, составляет 60—65 А.
Другие примеры адсорбции органических катионов на поверхности кремнезема описаны в связи с рассмотрением флокуляции в гл. 4.
Бийстербош [330] выполнил детальное исследование адсорбции RN+(CH3)3 (где R н-С12Н23 или н-СівН33) на различных типах кремнезема. Он подтвердил, что в воде идет образование двойного слоя на поверхности кремнезема вблизи к. к. м. Ближайшие к поверхности органические катионы нейтрализуются группами SiO~ на поверхности кремнезема, а катионы, нахо
дящиеся дальше в глубине раствора, сопровождаются эквивалентным числом анионов В г-, как это показано на рис. 6.12, а.
Значение гидрофобных связей или формирования мицелл было раскрыто, когда вместо воды стали использовать водный 1 М раствор н-бутанола. При рН 10, когда поверхность кремнезема сильно заряжена, необратимо адсорбировался монослой ионов Ci6H33N(CH3)+ (т. е. ионов ЦТМА) даже при их наи-
(а)
Br" Br"Br" Вг Вг"Вг"
|
О ґ+) |
- - - - - да, *
|
<У |
І
(±) WW li>
(6)
Н н н
|
Н,0 |
|
ВЬ(Ж)<Ж)(Ю (Ш |
Я. R
|
(г) |
|
Н Я |
Н
|
М^М^Мд. М |
|
Ff) (+) |
|
GZDOx С~Ю і ("уд |
|
Щ Щ (±) |
А ^
IOGH) 10Г~) ioCZ>
SiO,
Рис. 6.12. Схемы стадий адсорбции на поверхности кремнезема додецил - и це - тилтриметиламмониевых ионов.
Й — двойной слой; б — монослой в присутствии молекул спирта BuOH; в — единичная молекула в присутствии молекул спирта ВиОН; г — спаренный (дуплекс) слой. М - — ион
HSi03 . (По данным Бийстербоша [330!.)
Меньшей концентрации в растворе. При этом никакого второго слоя не образовывалось, а также не адсорбировались бромидные ионы. Поверхность стала покрываться при гораздо более низких концентрациях ЦТМА в спиртовом растворе по сравнению с водным раствором. Объяснение этого факта заключается в том, что гидрофобный слой на поверхности покрывается перевернутым слоем спиртовых молекул н-BuOH, как это показано на рнс. 6.12, б. При более низком покрытии поверхности могут быть адсорбированы и одиночные ионы ЦТМА, что изображено на рис. 6.12, в, так как молекулы спирта окружают углеводородную цепь. Это вызывает понижение энергии поверхности раздела между углеводородом и водой.
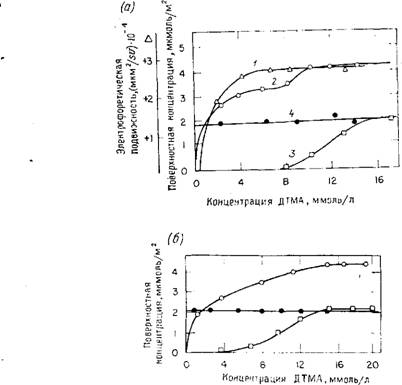
Некоторые из полученных Бийстербошем кривых, показывающих адсорбцию додецилтриметиламмониевых ионов (ДТМА) на гидроксилированной поверхности кремнезема, представлены на рис. 6.13, а. Он дает следующее объяснение двух уровней, наблюдаемых при адсорбции на стадиях 2 и 3.
Стадия 1. Согласно Прусту и Тер-Минасян-Шараге [331], на первом этапе адсорбции длинные цепи лежат почти параллельно
|
Рис. 6.13. Зависимость электрофоретической подвижности и адсорбции ионов додецилтриметиламмония ДТМА+ и ионов Вг~ на полностью гидроксилированной поверхности частиц кремнезема BDH (полученного осаждением) (а) от концентрации ДТМА в растворе при рН 10 и на частично дегидроксилированной поверхности кремнезема Cab-0-Sil (б). 1 — электрофоретическая подвижность положительно заряженных частиц; 2 — поверхностная концентрация ионов ДТМА+, адсорбированных из воды; 3 — поверхностная концентрация ионов Вг-, адсорбированных из воды: 4 — поверхностная концентрация ионов ДТМЛ+, адсорбированных из 1 М раствора к-бутилового спирта в воде: в последнем случае ионы Вг - не адсорбировались. (По данным Бийстербоша [330].) |
Поверхности, несколько перекрывая друг друга, причем каждая молекула занимает площадь 110 А2, что соответствует поверхностной концентрации 1,5 мкмоль/м2 при концентрации ДТМА в растворе 1 ммоль/л. На этой стадии кривая, отражающая присутствие заряда на частицах, не проявляется (рис. 6.13 а), что свидетельствует о величине концентрации заряженных групп на поверхности кремнезема, примерно равной 1,5 мкмоль/м2, или 0,9 SiO~-rpynn/HM2. При рН 10 концентрация силикатных
34 Заказ № 250
Ионов, находящихся в равновесии с мономером,,составляет около 0,004 н.; по данным Болта (см. рис. 4.10), плотность поверхностных зарядов должна быть равной приблизительно 1,0 SiO~- групп/нм2, что примерно совпадает с величиной, найденной на стадии 1.
Стадия 2. При переходе от стадии 1 к стадии 2 цепочечные молекулы плотно упаковываются, как показано на рис. 6.1-3, а, и затем, на стадии 2, выстраиваются вертикально к поверхности. При этом поверхность все более положительно заряжается по мере того, как все большее число дополнительных ионов ДТМА+ начинает удерживаться на поверхности посредством гидрофобных связей со смежными цепями. Согласно Прусту и Тер-Мина - сян-Шараге [331], каждая молекула, когда она адсорбируется вертикально к поверхности, занимает площадь около 60 А2, что соответствует поверхностной концентрации, равной 2,8 мкмоль/м2. Это, вероятно, объясняет ступеньку при величине поверхностной концентрации около 3 мкмоль/м2, наблюдаемую на рис. 6.13, а. Однако так как такие дополнительные катионы присоединяются в виде двойного слоя к поверхности, то они не могут нейтрализоваться дополнительными поверхностными зарядами. Они должны иметь противоионы — анионы в растворе. Однако анализ показывает отсутствие каких-либо адсорбированных ионов Вг~. Такими противоионами должны быть силикатные ионы HSi03, которые неизбежно образуются в растворе при рН 10. Добавленные ионы ДТМА должны находиться в плотно упакованном слое, причем у половины всех имеющихся в слое четвертичных аммониевых ионов концы направлены от поверхности, как это показано на рис. 6.12, г. Действительно, даже с самого начала процесса адсорбции некоторые ионы ДТМА+ должны иметь катион - ную Ы+-головку, направленную наружу от поверхности.
Такой монослой с чередующейся ориентацией ионов носит название «спаренного (дуплексного) монослоя». Подобный монослой является одним из типов, предложенных Тер-Минасян - Шарагой [326] для описания адсорбции димеров.
Однако возникает вопрос, почему для данного типа монослоя противоионами оказываются ионы HSiO~, а не Вг-. Действительно, анализ показывает отсутствие адсорбированных ионов Вг - на этой стадии. Поскольку концентрация ионов Вг^ в растворе превышает концентрацию ионов HSiO~, то должна-быть
Некоторая стерическая причина, почему ионы Вг - не располагаются вблизи двойного слоя. Ниже будет показано, что в спаренном монослое углеводородные цепи способны плотно упаковываться вместе, так как только каждая вторая углеводородная цепь может совмещаться с поверхностью своей более широкой катионной группой (CH3)3N+R, как показано на рис. 6.12, г.
Плотность упаковки, или поверхностная концентрация в таком спаренном монослое, следовательно, составляет около 3 мкмоль/м2, что соответствует 1,8 молекул/нм2. Площадь, занимаемая одной молекулой на поверхности, составляет 55 А2. К более просторному размещению этих молекул в слое лучше приспосабливаются силикатные ионы.
Стадия 3. Как видно из рис. 6.13, а, на этой стадии начинают адсорбироваться ионы Вг~ и формируется обычный двойной слой. Ионы ДТМА+, находящиеся в спаренном слое, таким образом, полностью перестраиваются, как показано нарис. 6.12, а. На единицу площади (1 нм2) в положении 6.12, а приходится большее число ионов ДТМА+, чем в положении 6.12, г. При значении поверхностной концентрации 2,0 мкмоль/м2 каждый ион ДТМА+ занимает площадь 83 А2 и каждой молекуле, присоединенной к поверхности, соответствует одна молекула, повернутая катионом наружу, в раствор, причем ближайшим ионом в растворе оказывается ион Br-.
При переходе от стадии 2 к стадии 3 дополнительно адсорбируется 1 мкмоль ионов ДТМА+, что приводит к повышению поверхностной концентрации от 3 до 4 мкмоль/м2, и одновременно адсорбируются 2 мкмоль ионов Вг~ на 1 м2.
Если поверхность образца кремнезема марки Cab-0-Sil частично дегидроксилирована и ее большая часть оказывается си- локсановой и гидрофобной, то, как показано на рис. 6.13, б, уже при низких концентрациях ионов ДТМА+ начинает формироваться двойной слой, что обнаруживается по адсорбции ионов Вг-. Вероятно, на силоксановых участках поверхности адсорбируется некоторое количество ионов ДТМА+, причем гидрофобные концы ионов обращены к гидрофобной силоксановой поверхности, а катионы направлены в раствор.
В заключение Бийстербош продемонстрировал, что в присутствии к-бутилового спирта на поверхности кремнезема с гидроксилированной и с частично дегидроксилированной поверхностью адсорбируется монослой с концентрацией примерно 2,0 мкмоль/м2. По-видимому, это соответствует максимальной плотности упаковки ионов ДТМА+ на поверхности, когда катионные (CH3)3N+-rpvnnbi обращены к поверхности (см. рис. 6.12, б).
Совершенно ясно, что в этой системе главную роль играют гидрофобные связи. Приведенные в табл. 6.5 численные данные, полученные из графических зависимостей Бийстербоша, показывают, что максимальные значения поверхностных концентраций на кремнеземах достигались для ионов ЦТМА н ДТМА на обоих указанных типах кремнеземных поверхностей как в случае водной фазы, так и 1 М. водного раствора н-BuOH. Эти данные также показывают, что в присутствии молекул спирта «-ВиОН 34*
|
Таблица 6.5 Максимальная поверхностная концентрация адсорбционных катионных ПАВ при различных значениях рН (по данным [330])
|
Основным фактором, вызывающим адсорбцию, оказывается присутствие зарядов на поверхности кремнезема, притягивающих катионы с длинными цепями. В воде проявляется дополнительный фактор — стремление гидрофобных катионов, если из них не сформировались мицеллы посредством гидрофобных связей, избавиться от воды и повернуться катиоиной головкой к поверхности кремнезема. Это четко прослеживается при рН 8, когда проявляется гораздо более сильная адсорбция из водной фазы, чем адсорбция из смеси бутанол—вода, так как основным фактором в последнем примере оказывается только слабый поверхностный заряд (см. табл. 6.5). Длинноцепочечные ионы ЦТМА+ проявляют более сильную тенденцию к освобождению от воды с образованием мицелл.
Примеры, когда суммарная адсорбция ионов из воды достигала 4,5 и 5,5 мкмоль/м2, т. е. адсорбированное количество было больше по сравнению с нормальным двойным слоем, могут быть объяснены более высокой плотностью упаковки во внешней части двойного слоя, достигаемой в результате ступенчатого расположения расширенных катионных групп при вертикальном направлении ионов к кремнеземной поверхности.
При адсорбции четвертичных аммониевых ионов ионное притяжение оказывается вторичным фактором, что также было показано Блекманом и Хэрропом [332]. Они наблюдали, что ионы
Типа RN(CH3)^", где R— алифатическая цепь, могли легко смываться с поверхности кремнезема, если R-группа оказывалась короче, чем Се. Подобным образом для цепей С]2—Cig было замечено понижение точки к. к. м. примерно в 15 раз, и, как по - казано Бнйстербошем, концентрация, необходимая для формирования монослоя на поверхности кремнезема, понижается по крайней мере в 8 раз. Механизм адсорбции четвертичных аммониевых ионов на кремнеземе все еще остается спорным. Блек- манн и Хэрроп пришли к заключению на основании исследований ИК-спектров, что ионный обмен в таких случаях не происходит; вместо него наблюдалось ослабление полосы поглощения групп SiOH, находящихся на поверхности кремнезема, которое показывает, что атом кислорода силанольной группы связывался до некоторой степени с Ы+-катионом. Последнее напоминает своеобразный комплекс хлоргидрата диэтиланилина и кремневой кислоты (см. лит. в гл. 3 [170]). Конечно, вполне возможно, что при низком значении рН ионный обмен не включается в механизм адсорбции; однако выше рН 8 ионообменный механизм представляется убедительным.
Применение катионных ПАВ при отделении кремнезема от руд посредством пенной флотации типично для технологических процессов, как это показано Хедбергом [333] в приведенном им сравнении методов обогащения различных типов руд.