Многозарядные катионы металлов
Для получения дополнительной информации и примеров следует обратиться к библиографии, приведенной в предыдущих главах. Так, в гл. 1 рассматривалось воздействие, оказываемое адсорбированными ионами Ва2+ и А1э+ на растворимость кремнезема; в гл. 3 было описано взаимодействие кремневой кислоты с некоторыми ионами металлов;в гл. 4 показано, что адсорбированные на поверхности коллоидного кремнезема катионы участвуют в процессе коагуляции (см. лит. к гл. 4 [256—268]); адсорбция ионов на силикагелях и порошках изложена в гл. 5.
По-видимому, общее правило заключается в том, что кремнезем, суспендированный в растворах большинства солей поливалентных металлов, начинает адсорбировать ионы металла, когда значение рН возрастает на 1—2 единицы выше, чем величина рН, при которой осаждается гидроксид соответствующего металла. Это явление необычно, так как естественно было бы предположить, что адсорбция должна происходить только тогда, когда значение рН достаточно высоко, чтобы кремнеземная поверхность становилась ионизированной и на ней образовывался отрицательный заряд. Число заряженных центров на поверхности кремнезема мало при рН 5 и равно нулю при рН 2 (см. главы 3 и 4), но все же поверхность адсорбирует определенные многозарядные катионы очень сильно и при низких значениях рН, как это имеет место, например, для ионов U022+, Fe3+, Al3+
И Сг3+ [213, 214]. Однако эти ионы не являются единственными простыми ионами, которые могут адсорбироваться. При тех значениях рН, когда ионы сильно адсорбированы, они оказываются полимеризованными до различных степеней и существуют уже в виде чрезвычайно небольших по размеру положительно заряженных коллоидных оксидных частиц или многоатомных катионов.
Одиночные катионы, подобные таким, как U022+, U4+, Pu4+,
•адсорбируются при удалении с поверхности одного иона Н+ в расчете на один ион металла. К тому же ионы Th4+, Fe3+ и А13+ адсорбируются аналогичным образом при низком значении рН, когда в отсутствие таких ионов группы SiOH обычно не должны ионизироваться [215, 216].
Визе и др. [217] обсудили вид адсорбции ионов, при которой их адсорбированные количества превышают эквивалентный поверхностный заряд. Когда ионы способны адсорбироваться даже при значении т. н. з., такая адсорбция называется «сверхэквивалентной».
Кольшуттер и др. [218] в качестве типичного примера исследовали адсорбцию на кремнеземе ионов алюминия А13+, гид - ролизованных ионов А13+ или многоосновных катионов. Авторы измеряли изменения величины рН в растворах А1СЦ, гидроли - зованных до различных степеней, по мере того, как происходила адсорбция разновидностей ионов алюминия.
В связи с изучением флокуляции коллоидного кремнезема Матиевич, Мангравите и Кассел [219] определили то значение рН, при котором ионы А13+ в нитратном растворе вызывали флокуляцию. В этом примере был выбран коллоидный кремнезем людокс-АМ, на котором содержалось примерно 0,4 центра SiAlO", предварительно нанесенных на поверхность кремнезема, чтобы вызвать появление на ней отрицательных зарядов при рН, пониженном до 3. (Этот случай отличается от немоди - фицированной поверхности кремнезема, когда поверхностный заряд становится очень небольшим ниже рН 4,5). Адсорбция ионов алюминия происходила и вызывала флокуляцию при рН 3, т. е. когда отрицательный заряд на поверхности был частично нейтрализован. Затем выше рН 3,3 поверхность постепенно приобретала положительный заряд по мере того, как все большее количество ионов алюминия адсорбировалось, после чего частицы кремнезема начинали вести себя подобно частицам оксида алюминия. Таким образом, флокуляция происходила при рН 6,0—6,5, иначе говоря, при том же самом значении рН, при котором гидроксид алюминия осаждался из нитратного раствора.
Наблюдалось также хорошее доказательство того факта, что ионы А13+, которые, очевидно, полимеризовались в течение периода флокуляции, составлявшего 24 ч,, адсорбировались затем в виде поликатионов АЬ(ОН)4+ или по крайней мере в виде некоторой разновидности полиона, в котором на два атома Алюминия приходился один положительный заряд. Как было показано [220], структуру основного поликатиона алюминия после продолжительного старения или старения при повышенной температуре можно представить как А1із04(0Н)24(Н20)^+. Матие-
Вич [221] отметил, что имеется пороговое значение рН, при котором катионы вызывают флокуляцию отрицательно заряженных частиц коллоидного кремнезема. При этом значении и выше него катионы адсорбируются на поверхности кремнезема. В отсутствие алюмосиликатных анионов на кремнеземной поверхности адсорбция разновидностей катионов А13+ происходит при рН 3,5—3,75.
Число хлорид-ионов, находящихся вблизи ионов А13+, которые адсорбированы на кремнеземе с дегидроксилированной поверхностью, зависит от степени гидроксилирования поверхности. Согласно данным Кольцова и др. [222а], при предельно гидро - ксилированном состоянии поверхности алюминий адсорбировался в виде (SisO)2AlCl, но на дегидратированных образцах кремнезема только единичная поверхностная группа SiOH вступает в реакцию с образованием SisOAlCl2.
Когда ион металла склонен к сильному комплексообразова - нию и в действительности ведет себя подобно катиону сильного основания, то, очевидно, такой ион перемещается ближе к поверхности и индуцирует появление на поверхности отрицательных зарядов (SiO-), причем число отрицательных зарядов на поверхности будет равно числу зарядов катионов; при этом высвобождается эквивалентное число ионов Н+. Выдра и Маркова [2226] изучили это явление на этилендиаминовых комплексах ионов Ag~, Zn2+, Си21-, Со2+ и Со3+. В случае ионов кобальта в растворах NH4OH комплекс Cb(NH3)3+ оказался настолько стабильным, что адсорбировался на кремнеземе без изменений. Однако комплекс Со2+(Н20)6 адсорбируется предпочтительнее, чем комплексный аммиакат [223].
Маатман [224] обсудил обычно применяемые методы, используемые для обработки поверхности раздела кремнезем—■ раствор. Ввиду близкого расположения групп SiOH на поверхности он представил кремнеземную поверхность в виде поли - дентатного лиганда.
Интересно отметить, что не только кремнезем обладает оксидной поверхностью, которая склонна к образованию хелатов. Хол и Стамм [225] нашли, что ион РЬ2+ прочно адсорбируется на поверхности і>-АІ203 при рН 7, т. е. когдд. такая поверхность еще несет некоторое число положительных зарядов. Вероятно, .атом свинца координирует с атомом алюминия на поверхности
В виде А1\ / РЬ. Несмотря на то что при данном значении рН чО
Кремнезем заряжен отрицательно, тогда как оксид алюминия заряжен положительно, сродство иона РЬ2+ к поверхности оксида алюминия оказывается на несколько порядков больше, чем к поверхности кремнезема. Таким образом, специфическая адсорбция ионов зависит не от величины ионного заряда'и кислотности поверхности, а от геометрии координационных связей, которые могут образоваться.
Адсорбция ионов железа исследовалась менее подробно, чем ионов алюминия. Потт и Мак-Николь [226] изучили координационную структуру и валентность ионов железа. Они наблюдали за поведением ионов Fe3+, адсорбированных на кремнеземе, после чего адсорбент нагревали до 400°С. Было показано, что ионы Fe3+ выше 400°С принимали тетраэдрическую координацию, а при 800°С кристаллизовались до a-Fe203. Шенк и Вебер [227] исследовали взаимодействие, железа с кремнеземом в коллоидном растворе и нашли, что кремнезем катализировал окисление двухвалентного железа до трехвалентного. Адсорбция ионов Fe3+ и Сг3+ на кремнеземе исследовалась Хили, Купером и Джеймсом [228] в зависимости от величины рН и ионной силы. Полученные различия в адсорбции этих ионов были объяснены на основе понятий координационной химии.
Боем [8] рассмотрел роль образования координационных структур и отметил, что адсорбция многоатомных ионов по существу фактически необратима. Образование хелатных поверхностных соединений, вероятно, требует участия групп SiOH на поверхности, которые замещают некоторое число молекул воды из иона металла:
Н Н., (/i—i)+
SiOH НД , /0Нг"' Si-Ц 9 рн2
- нх>м-он2 w' , н + н, о
SisOH
Н20 ОН2 Sis—о ^ Ън2
Замещение групп, координированных на ионах металла, поверхностными группами SiOH было экспериментально исследовано Кольтхоффом и Стенжером [229]. Они обнаружили, что когда ион Cu(NH3)2+ адсорбировался на поверхности кремнезема, то отношение NH3: Си становилось менее чем 4:1. В некоторых случаях [230] в реакцию включались три силанольные группы, как, например, это имело место для иона Zn2+:
3SisOH + ZnCl2 + 2NH4C1 = [(SisO)3 Zn2+Cl]2~ + 2NH| + 3HC1
Хили, Джеймс и Купер [231] сообщили о сильной адсорбции ионов металла на кремнеземе. При рН<6 кобальт адсорбировался из Ю-5 М раствора Со2+ неспецифически, как и при обычном ионном обмене. Выше рН 6,5, но ниже точки начала осаждения Со(ОН)2 ионы кобальта перемещались в поверхностный слой кремнезема, при этом одна из шести молекул воды, окружающих ион кобальта, замещалась одной группой SiOH:
SisOH + Со (Н20)|+ = Si/): Со (Н20)2+
Н
Следовательно, знак заряда на кремнеземной поверхности изменялся на обратный, и поверхность становилась положительно заряженной в соответствии с характером ионов гидроксида кобальта.
Кикучи и др. [232] использовали измерение магнитной восприимчивости, чтобы определить конфигурацию медных комплексов с ацетилацетоном и дифенилпикрилгидразидом на силикагеле. Очевидно, адсорбция тетрагональных плоских молекул ацетилацетоната происходила в виде квадратных лоскутов, так что молекулы адсорбата состыковывались по краям наподобие плоского кристалла.
Бурвелл и др. [233а] также изучали поведение некоторых координационных комплексов, адсорбированных на кремнеземе. Авторы показали, чго когда комплексные ионы адсорбируются на поверхности кремнезема, то ион SisO~ может проникать внутрь и замещать лиганд из координационной сферы атома ме
талла, образуя, таким образом, ковалентную связь между этим комплексом и поверхностью кремнезема:
[С1гСо(еп)2]- + osi, -. (C!2Co(en)2j - osi, (зеленое окрашивание)
.с
[Cl2Co(en)2]* OSis _ (enbCo^ J - неї
|
En = NH2C2H, NH2. |
О Si,
(розовое окрашивание)
Аналогичные реакции имеют место с ионами цис-Со(еп)2Х XN02C1+ и (en)2PtBr+.
Полное покрытие всей поверхности кремнезема оксидом циркония использовалось для обеспечения более прочного закрепления на адсорбенте монослоев биохимических веществ, например энзимов [2336]. Подобные пористые стекла, покрытые оксидом циркония, нашли применение; их преимущества, которые заключаются в заметно большей инертности и нерастворимости, описаны формой-изготовителем [233в].
Адсорбция из раствора сильной кислоты. Ряд металлов, обладающих высокой валентностью, т. е. находящихся в наибольшей степени окисления элемента, обычно способны сильно адсорбироваться при рН 2 или ниже, а некоторые элементы могут адсорбироваться даже из раствора сильной кислоты. Например, Fe3+ адсорбируется при рН 2. Сурьма, молибден, вероятно, ванадий, тантал, ниобий, торий, цирконий, уран, плутоний и протактиний адсорбируются при рН 0 или ниже.
По-видимому, еще мало известно относительно механизма, благодаря которому ионы с такой различной основностью способны связываться с поверхностью кремнезема. Формирование хелатных поверхностных соединений или совмещение кислородных связей в подобных оксикатионах, как, например, в UO|+,:
С соответствующими атомами на поверхности кремнезема, вероятно, способствует образованию множества ковалентных связей.
Обычно принято думать, что при промывании кремнезема сильной кислотой удаляются все загрязнения. Однако несколько элементов поразительно сильно адсорбируется и в этом случае. Сурьма адсорбируется из раствора крепкой азотной кислоты [234]. Хром в виде иона Сг6+, согласно данным Диббса [235], остается на поверхности плавленого кварцевого стекла после обработки адсорбента очищенным раствором H2Cr04+H2S04 и даже после промывания смесью HN03 и H2S04, причем на поверхности остается 0,1 мкг/см2 хрома. Однако при обработке адсорбента высушенным газообразным НС1 при температуре 180°С удается удалить все ионы Сг3+ и Сг6+ в основном в виде Сг02С12 [236]. Ниобий и цирконий настолько сильно адсорби-
33 Заказ № 250
Руются на кремнеземе, что могут избирательно извлекаться из растворов солей урана [237].
Обращение знака заряда на поверхности кремнезема. Растворимые гидролизованные ионы Th4+, Zr4+, Ве2+, Zn2+, Fe3+ и А13+ способны прочно адсорбироваться на кремнеземе, поэтому когда они содержатся в избыточном количестве по сравнению с тем содержанием, которое требуется для образования покрытия на поверхности кремнезема, то положительный поверхностный заряд меняется на отрицательный. Гидролизованные полимерные разновидности или основные соли металлов адсорбируются на кремнеземе при значительно меньшей величине рН, чем это наблюдается для простых гидратированных ионов. Механизм изменения знака заряда, как рассматривалось в гл. 4 в связи с обсуждением вопроса о коллоидных частицах кремнезема, в равной мере хорошо применим ко всем кремнеземным поверхностям (см. лит. к гл. 4 [424—435]). Подробное рассмотрение примера, связанного с изменением знака заряда, исследованного в работе [219], приводилось выше при описании адсорбции ионов алюминия. Как отметили Джеймс, Визе и Хили [276], в дисперсных системах, в которых наблюдается коагуляция под воздействием гидролизованных ионов металла, нет никакой очевидной корреляции между электрокинетическим потенциалом и устойчивостью коллоидной системы. Это показывает, что теория ДЛФО, по-видимому, не может быть применена. Авторы работы сравнивали адсорбционное поведение ионов Со2+, La3+, Th4+ на одном и том же образце Si02.
Прежде всего необходимо рассмотреть концентрацию катионов в растворе в отличие от их общего количества в системе, •в которое входят также катионы, адсорбированные на твердой поверхности. Так как обычно в системе известно лишь суммарное количество катионов, то концентрация коллоидных частиц, т. е. суммарная поверхность кремнезема в системе, должна сохраняться настолько малой, чтобы большая часть ионов металла все еще находилась в растворе.
По мере того как концентрация ионов металла возрастает в кремнеземном золе, поверхность частиц кремнезема постепенно покрывается адсорбированными поликатионами металла, которые в конце концов закрывают всю поверхность. При протекании этого процесса величина отрицательного заряда исходного электрокинетического потенциала поверхности кремнезема начинает уменьшаться, проходит через нуль и окончательно принимает положительное значение, соответствующее значению потенциала оксида алюминия, когда поверхность кремнезем-а полностью покрывается поликатионами.
Авторы отмечают, что коагуляция происходит, когда электрокинетический потенциал заключен в интервале от —14 до + 14 мВ. Представляет интерес вопрос о соотношении долей, занимаемых на поверхности катионными и анионными участками при этих крайних значениях электрокинетического потенциала. Такие соотношения могут зависеть в некоторой степени от размеров коллоидных частиц кремнезема и поликатионов.
Подобные воззрения приложимы только к системам, в которых поликатионы адсорбируются и способны покрывать поверхность кремнезема, и, следовательно, при этом может происходить обращение знака заряда поверхности на обратный. Однако они не применимы к коагулирующим системам, имеющим «плотный двойной электрический слой» вокруг частиц в растворах простых электролитов, разбавленных в отношении 1:1. Следует отметить, что и в случае катионов больших размеров, как, например, К+ и (СНзЬ^, может также происходить обращение знака заряда на поверхности, когда она становится полностью покрытой этими большими катионами.
Краткие выводы и обзоры. Известны некоторые общие обзоры по ионообменным свойствам кремнеземной поверхности и силикагелей, опубликованные за последние 25 лет, но лишь в немногих рассматриваются все аспекты этой темы. Бен - тон и Элтон [238] подсчитали энергию адсорбции ионов, находящихся в слое Штерна. Душина и др. [239] показали взаимосвязь между величиной рН и адсорбцией ионов металлов, которую они описали на основе растворимости, поверхностных соединений [240].
Минимальная концентрация ионов металла при специфической адсорбции (МКСА) была измерена Вакацуки, Фурукава и Кавагучи [241] на кремнеземе при разных значениях рН для 15 катионов. Специфичность была увязана со способностью атома металла образовывать ковалентные связи и понижалась в ряду в следующем' порядке: Ga3+, Al3+, Fe3+, Сг3+, V3+, Со2+, Cu2+, Zn2+, Ва2+, Sr2+, Са2+, Mg2+, Rb+, К+ и Na+. Константы равновесия для адсорбции ионов металлов на поверхности кремнезема были измерены Далангом и Стаммом [242].
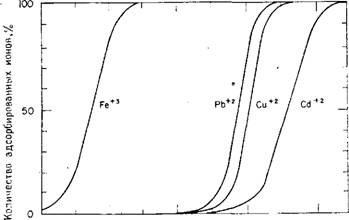
Лигандные свойства поверхностных силанольных групп для ионов металлов (Fe3+, Cu2+, Cd2+ и Pb2+) были измерены Шинд - лером и др. [191], а также были определены константы адсорбционного равновесия". Величина адсорбции ионов металлов в зависимости от рН показана на рис. 6.10.
Si/)H + Мг+ = SisOM. z~1 + Н+ *К\ 2SisOH + Мг+ = (SisO)2 Мг~ 1 + 2Н+ *BS2
Наблюдалось линейное соотношение между lg К\В2 и lg KiB2, где К\В2 — константа устойчивости гидрокомплексов ионов металла. Это показывает, что как лиганды SisOH и НОН имеют 33*
Сходство, и объясняет давно известный экспериментальный факт, что комплекс силиката металла осаждается при таком значении рН, которое только незначительно ниже, чем рН начала осаждения гидроксида металла в отсутствие кремнезема.
Арланд и др. [213] исследовали механизм адсорбции обычных и гидролизованных (основных) ионов металла. Была предложена термодинамическая модель системы.
|
О. 2 4 6,8 К. рН Рис. б.10. Зависимость суммарного процентного содержания адсорбированных ионов металлов от величины рН на гидроксилированной поверхности кремнезема. (По данным Шиндлера и др. [191]). |
Джеймс и Хили [243] предположили, что при адсорбции гид - ролизуемых ионов (поликатионов) на оксидной гидратирован - ной поверхности энергетические изменения за счет кулоновских сил и химических превращений, благоприятствующих адсорбции, уравновешиваются энергией сольватации, которая противодействует этому процессу.
Библиография по адсорбции ионов металлов на кремнеземе. Таблица 6.3 может служить в качестве руководства при поиске литературы, хотя и не является исчерпывающей. В таблицу включены литературные ссылки, относящиеся в основном к гидроксилированным образцам кремнезема. Комплексы ионов металлов включены в таблицу для тех случаев, когда лиганды определены, в других случаях можно допустить, что в качестве лигандов приняты ОН - или HgO. Степень основности или степень полимеризации обычно не указываются.
Таблица 6.3
Адсорбция ионов металлов на кремнеземе
|
Литература |
|
Элемент |
Примечание
Однозарядные ионы
Комплекс с этилендиамином То же
|
244 244 245 |
|
Таллий Серебро |
Комплексы с аммиаком и этилендиамином
Двухзарядные ионы
Найдена зависимость от размеров частиц Si02
Взаимодействие с литием Адсорбционные данные
Адсорбционные данные
Координирован одним ионом SiO-
Комплекс с этилендиамином
Комплексы с аммиаком и этилендиамином
Координирован двумя ионами SiO-
Комплекс с аммиаком
Возможная координация с полярными лн - гандами
Комплексы с хлором и этилендиамином Комплекс с этилендиамином Комплексы с аммиаком и этилендиамином Координирован одним ионом SiO~ Изучено состояние Со на поверхности
См, рис. 6.10
Комплекс с этилендиамином Несколько лигандов
Комплексы с аммиаком и этилендиамином Координирована одним ионом SiO~ Адсорбционные данные
Комплекс с этилендиамином Комплекс с аммиаком Координирован двумя ионами SiO - Адсорбционные данные
Адсорбируется выше рН 2,5
Адсорбируется ион (СгС12-4Н20)+, но не Сг3+
|
Сурьма |
Адсорбируется при рН>4 в виде гидро - ксида
См. рис. 6.10
Значение рН адсорбции зависит от анионов
|
Элемент |
Литература |
Примечание |
|
Хром (II) |
252 |
Стабилизированные комплексы Cr2+—NH3 |
|
Кадмий |
191 |
См. рис. 6.10 |
|
253 |
Взаимодействует с поверхностью в амми |
|
|
239 |
Ачном растворе |
|
|
Адсорбционные данные |
||
|
Олово (II) |
254 |
Использован эффект Мессбауэра |
|
255 |
То же |
|
|
Свинец |
191 |
См. рис. 6.10 |
|
256 |
РЬ удаляется из расплавленного висмута |
|
|
Палладий |
257 |
|
|
239 |
Адсорбционные данные |
|
Трехзарядные ионы |
Адсорбируется из сильнокислых растворов
Четырехзарядные ионы
275 Адсорбируется из кислого раствора
|
Цирконий |
261 Выделение из гафния
Адсорбируется только в виде продуктов гидролиза
Адсорбируется на гидрофобной поверхности Si02
Адсорбируется коллоидный Zr02; Zr4+
В 2 н. растворе HNO3 Адсорбируется на гидрофобной поверхности Si02
Адсорбируется только в виде продуктов
Гидролиза Выделение из циркония Адсорбируется даже из 10 н. кислоты; отделяется от ниобия Адсорбируется в виде нейтральных комплексов; адсорбируется из растворов кислот вплоть до 6 н. Адсорбируется из кислых растворов Адсорбируется при рН>1,5
Вероятно, адсорбируется в виде поликатионов
Сильно адсорбируется, отделяется от Th,
U, Zr, Hf, Nb Ионы Pu (OH) ^ ~ n) + адсорбируются при рН>1
Адсорбируется из Ю-7 М раствора золя
|
Элемент |
|
Примечание |
При нейтральном рН Адсорбируется при рН не выше 0,6—4,5; присутствует в виде частиц при рН 1,5— 8,5
Шестизарядные ионы
Хром (VI)
Дихромат
(Сг2072~) Уран (VI) (или U022+)
Ион стабилен до 565°С; пригоден как катализатор полимеризации SiOCr (О) 2ОСг (О) 2ОН
Адсорбируется на Si02, нагретом до различных температур
Ион U02s+ замещает один ион Н+