Химия и технология лакокрасочных покрытий
ХАРАКТЕРИСТИКА КОРРОЗИОННЫХ ПРОЦЕССОВ
Существуют термодинамический и электрохимический подходы к оценке коррозионных процессов. С термодинамической точки зрения условием растворения металла является убыль изобарно-изотермического потенциала ДС, т. е.
АС = -пРЕ<0,
Где Е- разность потенциалов или ЭДС электрохимического элемента.
Это условие обычно выполняется при наличии электролита и деполяризатора, обратимый окислительно-восстановительный потенциал которого положительнее обратимого потенциала металла.
Согласно электрохимической теории в основе коррозионного разрушения металлов лежат три процесса:
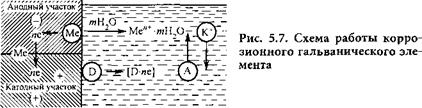
1) анодный, связанный с образованием гидратированных ионов металла в электролите и некомпенсированных электронов на анодных участках по реакции:
Пе — Ме —и► Ме”+ ■ ТН20;
2) катодный процесс ассимиляции электронов деполяризаторами и ионами или молекулами раствора, способными к восстановлению на катодных участках по реакции:
Э + Пе —► [Э - Пе];
3) процесс перетекания электронов по металлу от анодных участков к катодным и перемещения катионов и анионов в растворе.
Таким образом, коррозия металла представляется как результат работы большого числа коррозионных гальванических элементов, возникающих на отдельных участках поверхности вследствие ее гетерогенности. Электрохимическая гетерогенность поверхности металлов, обусловливающая ее дифференциацию на анодные и катодные участки, может быть вызвана разными причинами: наличием примесей других элементов в виде макро - и микровключений, анизотропностью кристаллической решетки, присутствием оксидов и других загрязнений, неравномерностью приложенных внешних нагрузок и т. д. На рис. 5.7 приведена принципиальная схема работы коррозионного элемента, состоящего из двух разнородных участков поверхности.
|
|
Закономерности электрохимического поведения металлов определяются их химической природой, составом электролита и внешними условиями протекания процесса. В зависимости от этого возможны разные виды анодных и катодных реакций. Так, наряду с процессом ионизации анодное растворение металла может сопровождаться следующими реакциями:
Me + ПН20 — Me(OHU + ПН+ + «е,
Me + ПОН~ —► Ме(ОН)Д + «е,
Me + ПН2 О —- Ме(ОН)Г + 2пН+ + Ne.
Первые две реакции характерны для многих металлов в нейтральных и щелочных средах, последняя свойственна металлам с резко отрицательным потенциалом.
Наиболее типичными катодными процессами являются:
1) восстановление водорода из ионного состояния (водородная деполяризация)
Н+-Н20 + е —- H + Н20 72Н2Т + Н20;
2) восстановление металла из ионного состояния
Ме;,+ • mH20 + Ne —► Me + wH20;
3) восстановление кислорода с образованием гидроксильного иона (кислородная деполяризация)
2 + 4е + 2Н20 — 40Н~.
Первая реакция, у которой D = Н+, т. е. Водородная деполяризация, свойственна большинству металлов в кислых средах, а также некоторым металлам, например магнию, в нейтральных электролитах. Условия ее протекания - высокая активность водородных ионов и превышение потенциала их разряда £,< над потенциалом металла £Ме> т. е. £Ме < Значения Д<, при которых происходит выделение водорода на катоде, обычно меньше равновесного водородного потенциала £н2> и требуется приложение дополнительного напряжения для протекания электродного процесса. Эта разность потенциалов г| = Еи2 - Д< определяет значение водородного перенапряжения, кото
Рое является причиной поляризации в катодном процессе. Перенапряжение водорода зависит от природы металла и состояния его поверхности. Наиболее высокие значения г|, достигающие 1 В, имеют РЬ, Н& В1.
Коррозия металлов в нейтральных, слабокислых средах и во влажном воздухе протекает с Кислородной деполяризацией. Это наиболее распространенный вид коррозионных разрушений. Он осуществляется с участием кислорода воздуха, содержащегося в электролите или адсорбированного поверхностью металла. Протекание коррозии металла с кислородной деполяризацией возможно, если £Ме < Ео2. Так как потенциал кислородного электрода всегда положителен (в зависимости от pH среды изменяется от +0,40 до +1,23 В), то этому виду коррозии подвержена большая часть металлов. Высокие значения изо - барно-изотермического потенциала АС и соответственно ЭДС имеют, в частности, такие металлы, как М& Ъп, Бе; неслучайно они быстро корродируют во влажной атмосфере при наличии кислорода воздуха. Разрушение железа протекает по следующей суммарной реакции:
4Бе + 2Н20 + 302 — 2Ре2Оэ • Н20.
Анализ электрохимических процессов разрушения металлов показывает, что материальный эффект коррозии является результатом анодного процесса, интенсивность которого определяется силой протекающего между анодным и катодным участками поверхности коррозионного тока /:
Я=Ю т,
Где £ - уменьшение массы металла; К - постоянная, зависящая от атомной массы металла А, его валентности П и числа Фарадея К = А/пР; т - время.
Отношение силы коррозионного тока к площади корродирующей поверхности металла (его анодных участков) 5а характеризует коррозионную плотность тока Г
1 = 1/5«
Которая является важным показателем в оценке коррозионных разрушений.