Вторичная переработка пластмасс
Антиоксиданты
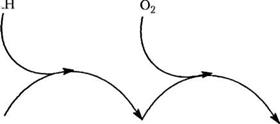
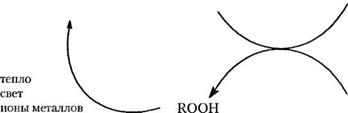
На схеме 2.10 показана реакция окисления, которую мы обсуждали в разделе 2.3; схема представляет собой смыкающиеся циклы разложения и регенерации гидропероксида. В принципе, любой реагент, который может внедряться в какой бы то ни было цикл, будет снижать скорость окисления. Однако подходящие химические составы могут оказаться весьма различными на стадии производства и при конечном использовании.
Фактически существует два наиболее легко захватываемых ингредиента — алкилпероксорадикалы и гидропероксиды. Существует множество антиоксидантов, применяемых для стабилизации полимеров; их химические свойства подробно описаны [36-41]. Термические антиоксиданты делятся на две основные категории.
|
Г”
|
|
ЛОО* |
![]() Я*
Я*
|
ЫН |
![]()
|
Схема 2.10. Основные реакции окисления полимера, показанные с помощью смыкающихся циклов, которые разрушают полимер через реакции разрыва связей с участием Алкоксирадикалов |
|
£Ви |
|
СИ г |
|
ИООН |
|
Антиоксиданты, обрывающие цепную реакцию Антиоксиданты, обрывающие цепную реакцию, — это агенты передачи цепи, Напротив, когда полимер находится на воздухе, его компонентам трудно кон- Ши + 1102 Схема 2.11 Хотя это ключевая реакция, феноксирадикал включается в дальнейшие реак- |

Эти сопряженные хиноны известны как одни из наиболее интенсивно окрашенных соединений [43] и принципиально важно минимизировать их образование, чтобы предотвратить пожелтение полимера в результате реакций антиоксиданта. Образование таких структур при окислительном взаимодействии фенольных групп при окислении — почти определенно основной путь развития окрашивания во многих полимерах, содержащих ароматические группы.
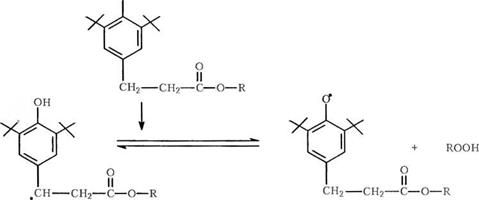
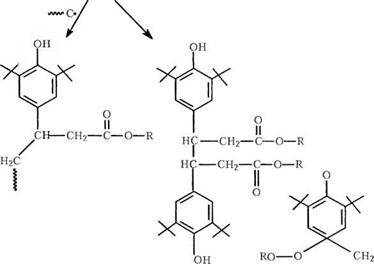
Большинство нынешних коммерческих фенольных антиоксидантов имеют пропионатную эфирную группу в 4-й позиции. Они сложным образом реагируют с радикалами (рис. 2.2)
Эти фенолы реагируют с радикалами со стехиометрической эффективностью свыше 1 и превращаются в стабильные продукты реакции без выхода окрашенных
|
V |
![]()
|
О II Сн2—с—о—к |
![]()
|
Рис. 2.2. Схематическое изображение сложной смеси продуктов, образующихся при окислении типичного фенольного антиоксиданта |
![]()
|
1Ю*2 |
|
|
Продуктов. Фенол, в конечном счете, истощается; в результате возникает индукционный период стабильности, за которым наступает быстрая деструкция полимера.
Подобные антиоксиданты основаны на ароматических амииах, как правило, на диариламинах. Они очень эффективны, но с ними связана проблема приобретения полимером окраски из-за образования высокосопряженных продуктов взаимодей - твия. По этой причине антиоксиданты на основе ароматических аминов имеют ограниченное применение и лишь в таких материалах, как, например, наполненная техническим углеродом резиновая смесь, где изменение цвета не имеет значения.
Мы уже говорили о различных условиях, встречающихся при производстве полимеров Хорошо известная эффективность блокированных фенолов как стабилизаторов расплавов, безусловно, связана с тем фактом, что их продукты окисления являются хорошими ловушками для алкилрадикалов (фенолы сами по себе намного более реактивны по отношению к кислородным радикалам, чем к углеродным радикалам) Недавно на рынке появились соединения с молекулами, специально построенными для захвата углеродных радикалов. Ниже приведен один пример акрилзамещеиного фенола, из разработанных Ячиго с сотрудниками [44, 45]:
|
С |
|
|
|
И |
|
К |
|
Схема 2.13 |
Акриловая группа в этих молекулах реактивна по отношению к С-радикалам. Присоединение дает новый радикал, который идеально расположен для реакции с фенолом. Химикаты-добавки этого типа особенно эффективны при стабилизации диеновых каучуков.
Другой недавно созданной группой агентов-ловушек для алкилрадикалов являются производные бензофуранона [46]:
Здесь реактивность обусловлена низкой энергией диссоциации связи С—Н до эфирной группы. В сочетании с фенолами эти антиоксиданты особенно эффективны для предотвращения образования геля при переработке диеновых ка - учуков, и они входят в состав синергических смесей для стабилизации полиоле - финов на стадии переработки.
Антиоксиданты, разрушающие пероксиды
Другую группу эффективных антиоксидантов составляют антиоксиданты, предназначенные для предотвращения инициирования окисления посредством разложения пероксидов до стабильных продуктов без выхода радикалов. Их часто называют «превентивными» антиоксидантами и делят на две группы. Первая группа стехиометрически восстанавливает пероксиды до спиртов; типичным примером являются эфиры фосфитов.
|
СоН |
|
9А114 |
|
|
||
Схема 2.15
|
Р~(ОР)з + шэС)- |
![]() Хогя фосфитные антиоксиданты являются иероксидолитиками, они могут также действовать как антиоксиданты, останавливающие цепь через захват ал - кокси - и алкилпроксирадикалов:
Хогя фосфитные антиоксиданты являются иероксидолитиками, они могут также действовать как антиоксиданты, останавливающие цепь через захват ал - кокси - и алкилпроксирадикалов:
|
-^0=Р-*ОР)з |
![]()
|
И* |
![]()
|
Р-(ОР)3 + ІЮ- |
![]()
|
Схема 2.16 Вторую группу составляют соединения, которые разлагают пероксиды каталитически, так что одна молекула химиката-добавки может разрушить очень много пероксидов. Типичными примерами являются эфиры тиодипропионата К0С0СН2СН25СН2СН2С0011, где II = С12Н25 или С1ЙН37, и соли тиокарбами - новых кислот с металлами. Эти химикаты-добавки эффективно взаимодействуют с серой и часто называются «тиосинергетики». Они действуют [47] посредством окисления серы через несколько промежуточных соединений и освобождают сульфокислоты, которые каталитически усиливают иоиный распад пероксидов. Каждая молекула антиоксиданта разрушает несколько молекул пероксида до того, как погибнет сама. |
![Антиоксиданты подпись: схема 2.16
вторую группу составляют соединения, которые разлагают пероксиды каталитически, так что одна молекула химиката-добавки может разрушить очень много пероксидов. типичными примерами являются эфиры тиодипропионата к0с0сн2сн25сн2сн2с0011, где ii = с12н25 или с1йн37, и соли тиокарбами- новых кислот с металлами. эти химикаты-добавки эффективно взаимодействуют с серой и часто называются «тиосинергетики». они действуют [47] посредством окисления серы через несколько промежуточных соединений и освобождают сульфокислоты, которые каталитически усиливают иоиный распад пероксидов. каждая молекула антиоксиданта разрушает несколько молекул пероксида до того, как погибнет сама.](/img/704/image058.gif) -► 0=Р—(ОР)з + ЫО
-► 0=Р—(ОР)з + ЫО
Стабильность полимеров может быть существенно нарушена при наличии ничтожных количеств переходных металлов, оставшихся от катализатора, резервуаров и технологического оборудования Они стимулируют разложение гидропероксидов с образованием радикалов и, таким образом, увеличивают скорость инициирования окисления [48]. Эта проблема приобретает большое значение, если полимерный материал находится в контакте с металлом, например, в инженерных сооружениях и особенно в кабельной изоляции. Многие соединения использовались в качестве добавок в полимеры для связывания в хелаты ионов металлов и ограничения их каталитическои активности. Типичные примеры показаны на схеме 2.17 [49].
|
О О Схема 2.17 |
Многие дезактиваторы металлов работают, частично образуя хелаты металлов, частично используя пероксидолитический эффект либо комплексов металлов, либо самих лигандов. Некоторые из них преднамеренно сочетают функцию образования комплексов металлов и функцию антиоксиданта в одной молекуле.