ВОЗОБНОВЛЯЕМЫЕ ИСТОЧНИКИ ЭНЕРГИИ
СТЕПЕНИ СВОБОДЫ
В формулы, которые мы получили для удельных теплоемкостей величины у входит величина v, равная числу степеней свободы молекулы, наших рассуждений следует, что v является целым числом и не должна за - : ь от температуры. Что показывают экспериментальные данные? Рассмотрим одноатомные газы. Атомы, из которых они состоят, имеют оступательные степени свободы. В этом случае величина у точно равна 2 3 = 1,667 (см. уравнение (22)). Как следует из данных, приведенных в
2.2, значение у для гелия, аргона и криптона приблизительно (но не точно) ожидаемому значению. Поскольку реальные атомы перечисленных газов * - ляются точечными объектами, т. е. имеют некоторый объем, то у них дол - зыть спин и по крайней мере одна дополнительная степень свободы долж - #Ы1ь приписана вращению вокруг собственной оси. В этом случае степеней гы должно быть не меньше четырех и, следовательно, у = 1 + 2/4 = 1,5, что меньше наблюдаемых значений, смотрим двухатомную молекулу водорода Н2. Она должна иметь три по - “ельные и две вращательные степени свободы. Кроме того, она может совер - олебательные движения, которые дают еще две степени свободы (одна — » нетической энергии колебаний, другая — для потенциальной). Таким
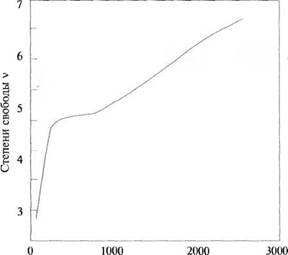
образом, полное число степеней свободы должно быть, по меньшей мере, равно семи и соответственно у = 1 + 2/7 = 1,286. При температуре 2300 К у для водорода равна 1,3, что соответствует значению v = 6,67. Как можно видеть из рис. 2.4, только при более высокой температуре число степеней свободы может достигнуть семи. При очень низких температурах значение v стремится к трем и молекулярный водород ведет себя, как точечная одноатомная молекула.
Между этими крайними температурами v плавно меняется, принимая дробные, не целые, значения. Ясно, что молекула может иметь только целое число степеней свободы, но газ, состоящий из большого количества молекул, характеризуется средним значением v, которое может быть дробным числом. При любой заданной температуре у некоторых молекул возбуждается меньшее число степеней свободы, в то время как у других — большее. Иными словами, принцип равного распределения энергии между степенями свободы (который требует равного распределения энергии между всеми степенями свободы всех молекул) нарушается. Таким образом, для реальных газов удельные теплоемкости и их отношение у зависят от температуры, хотя и не слишком сильно.
|
Температура, К Рис. 2.4. Зависимость числа степеней свободы молекулярного водорода от температурь. |
Для оценок можно достаточно предположить, что величины, о которых идет речь, являются константами. При проведении более точных расчетов необходимг обратиться к табличным данным (см., например, перечень экспериментальны. данных по ср и у для Н2, 02 и Н20, приведенных в табл. 7.5).
Некоторые общие положения, которые необходимо запомнить, состоят в следующем: переход к более сложным молекулам и более высоким температурам приводит к увеличению числа степеней свободы и, следовательно, к большим значениям удельных теплоемкостей и меньшим значениям величины у.
|
Таблица 2.2. Отношение удельных теплоемкостей для некоторых одноатомных газов
|