Утилизация и вторичная переработка пластмасс
Окисление полимерных пленок методом стабилизации
Старение – это самопроизвольный процесс, изменения свойств во времени. Наибольшее влияние на процесс старения оказывает кислород, другие факторы, такие как температура, свет, влажность, мех. воздействия и т. д. ускоряют процесс старения. Реакция окисления протекает по свободно-радикальному механизму. Для процесса старения ПП характерен первоначально процесс деструкции. ПП имеет тритичный атом углерода – это и приводит сразу к инициированию процесса деструкции за счет влияния кислорода или др. факторов. Рассмотрим реакцию окисления ПП: 1) Реакция инициирования.
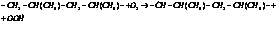 2. Развитие цепи.
2. Развитие цепи.
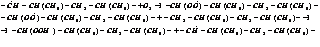 3. Разветвление.
3. Разветвление.
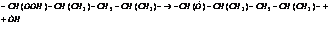 4. Обрыв цепи.
4. Обрыв цепи.
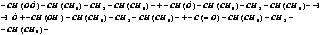 Стабилизация – это процесс восстановления определенного комплекса свойств полимеров. Часто восстановление связано с восстановлением структуры и молекулярной массы.
Стабилизация – это процесс восстановления определенного комплекса свойств полимеров. Часто восстановление связано с восстановлением структуры и молекулярной массы.
1. Антиоксиданты. ![]() + АН → RH +
+ АН → RH + ![]() В результате этого механизма водород переходит к свободному радикалу, в результате чего образуется малоподвижная, слабореакционноспособная молекула антиоксиданта. Слабореакционной молекула антиоксиданта является за счет распределения заряда.
В результате этого механизма водород переходит к свободному радикалу, в результате чего образуется малоподвижная, слабореакционноспособная молекула антиоксиданта. Слабореакционной молекула антиоксиданта является за счет распределения заряда.
 τ – период индукции, по которому можно посчитать активность стабилизатора (это для критической системы). ПП от 120 до 160°С.
τ – период индукции, по которому можно посчитать активность стабилизатора (это для критической системы). ПП от 120 до 160°С.
![]()
Как высчитать активность стабилизатора или антиоксиданта? Строят 3 кривые при разных температурах.
 Можно отметить уменьшение периода индукции, действия антиоксиданта или стабилизатора. Затем определяют скорость окисления при разных температурах (см. формула 1). Затем строятся следующие кривые:
Можно отметить уменьшение периода индукции, действия антиоксиданта или стабилизатора. Затем определяют скорость окисления при разных температурах (см. формула 1). Затем строятся следующие кривые:
Т измеряется в К. Кривые строятся минимум по 5 температурным точкам. По кривым вычисляют тангенс угла наклона. Берем 2 любые точки на кривой и вычисляем энергию активации:

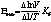 Кб – константа Больцмана. Чем выше энергия активации, тем эффективнее стабилизатор. С повышением температуры скорость окисления резко падает.
Кб – константа Больцмана. Чем выше энергия активации, тем эффективнее стабилизатор. С повышением температуры скорость окисления резко падает.
2. Ингибиторы окисления – обрывают реакцию окисления на стадии образования перекисей и перекисных радикалов, тем самым восстанавливают структуру полимера по следующей реакции:
RO ![]() + IH → RH + IO
+ IH → RH + IO ![]() Образовавшиеся радикалы с ингибитором вступают в реакцию между собой, образуя «сшитые» структуры, затем структура разрушается за счет насыщения и образуются стабильные или малореакционноспособные рад-лы след. состава: IȮ, İ (ингибитор или ингибитор с кислородом). По подобному механизмуобычно действуют сажи, лигнин, ароматические амины.
Образовавшиеся радикалы с ингибитором вступают в реакцию между собой, образуя «сшитые» структуры, затем структура разрушается за счет насыщения и образуются стабильные или малореакционноспособные рад-лы след. состава: IȮ, İ (ингибитор или ингибитор с кислородом). По подобному механизмуобычно действуют сажи, лигнин, ароматические амины.
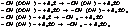 3. Восстановители – реагируют с гидроперикисными группами без образования или с незначительным выходом свободных радикалов. По такой схеме обычно работают органические сульфиды и фосфиты:
3. Восстановители – реагируют с гидроперикисными группами без образования или с незначительным выходом свободных радикалов. По такой схеме обычно работают органические сульфиды и фосфиты:
4. Дезактиваторы – это вещества, обычно ионы металлов переменной валентности, способные легко окисляться. В основном используются железосодержащие дезактиваторы, т. к. самые дешевые.
5. Стабилизаторы общего типа – это стабилизаторы, способные взаимодействовать на поверхности полимера с О2, не пропуская его во внутрь полимера. В результате образуются малореакционноспособные радикалы стабилизаторов, которые содержат группы О – О.
G + O2 → GO ![]() После расхода стабилизаторов (антиоксидантов) происходит ускорение процесса окисления, что в результате также приводит к образованию низкомолекулярных компонентов.
После расхода стабилизаторов (антиоксидантов) происходит ускорение процесса окисления, что в результате также приводит к образованию низкомолекулярных компонентов.