В ПОИСКАХ ТЯЖЕЛОЙ ВОДЫ
|
С |
Разу же после открытия дейтерия и его кислородного соединения — тяжелой воды — стали искать сырье, из которого можно было бы получать эти вещества в достаточных количествах. Прежде всего возник вопрос: нет ли в природе источников, богатых тяжелой водой? С этой Целью были проверены многие естественные воды. Пробы брали в различных точках и с разных глубин Атлантического и Тихого океанов. Были обследованы многие реки мира, пресные, соленые и высокогорные озера, горячие источники, ледники; анализировались рассолы из глубоких нефтяных скважин — и всюду содержание тяжелой воды оказалось примерно одинаковым — две сотых процента.
Те же результаты получены при анализе воды, выделенной из всевозможных минералов, воды, образовавшейся при сжигании нефти, угля и природных газов.
А не концентрируется ли тяжелая вода в организмах животных и растений, подобно некоторым солям? Испытали воду, выделенную из африканских и испанских апельсинов и кокосовых орехов, итальянских лимонов, румынских дынь, американской тыквы, гавайских ананасов, английских томатов и брюквы, голландского лука, тростникового сахара и самых различных пород древесины; анализировали молоко, кровь, желудочный сок различных животных. Словом, были проверены чуть ли не все вещества, содержащие в своем составе водород и его соединения. Результат один — в природе нет источников, обогащенных тяжелым водородом.
Означало ли это, однако, что ученые, убедившись в одинаковом изотопном составе любой воды на нашей планете, потратили впустую и силы и время? Совсем нет.
Дело в том, что 0,02 процента — это только приблизительная величина. В действительности же количество тяжелой воды в природных водах колеблется. Хотя эти колебания и весьма незначительны — в пределах нескольких тысячных долей процента, они указывают на то, что
В грандиозной лаборатории природы происходит разделение изотопов водорода. Конечно, этот процесс нигде не идет до конца.
Мы уже видели, что из природной смеси изотопов водорода, превращенной вжидкость, протий испаряется быстрее, чем дейтерий. Про обычную воду можно сказать то же самое. Она легче испаряется, чем тяжелая вода. К такому заключению можно прийти, сравнивая температуры замерзания и кипения этих жидкостей. Скорость испарения жидкости, при прочих равных условиях, определяется давлением ее пара. Чем больше давление пара, тем быстрее происходит испарение. Когда тяжелая вода при плюс 3,82 градуса превращается в лед, обычная вода при этой температуре остается еще жидкостью. Давление пара над тяжелым льдом будет меньше, чем над обычной жидкой водой при той же температуре. При 100 градусах обычная вода кипит, давление ее пара равно атмосферному давлению, температуру тяжелой воды надо поднять еще на 1,4 градуса, чтобы она закипела и давление ее пар>а сравнялось с давлением атмосферы.
Поэтому там, где есть условия для интенсивного испарения, вода, как правило, несколько обогащается дейтерием. Например, вода Мертвого моря, Каспия и большинства других крупных водоемов содержит несколько больше дейтерия, чем речная.
Воды рек и проточных озер умеренного пояса имеют примерно один и тот же изотопный состав. Но бывают и любопытные исключения. В западной части Канады есть город Трэйль. Вода в его окрестностях — ив реке Колумбии, и в озерах — беднее дейтерием, чем, например, в реке Гудзон. Это объясняется тем, что в окрестностях Трэйля дуют преимущественно юго-западные и западные ветры, пересекающие горную цепь Сьерра-Невада. Большая часть влаги, приносимой этими ветрами, теряется еще до того, как они достигают притоков реки Колумбии и озер - близ Трэйля. Пар из молекул тяжелой воды конденсируется быстрее пара обычной воды. Поэтому дожди, идущие над Трэйлем и питающие реку и озера, уже обеднены тяжелой водой.
В водах забайкальских рек — Шилки, Аргуни и Гази - мура — дейтерия меньше, чем в воде московского водопровода или в Волге, Днепре и Оби, но уже по другой причине. Обеднение забайкальских рек тяжелой водой связывается с вечной мерзлотой почвы. Она раньше выморажи -
Вается и меньше принимает участия в общей природной циркуляции воды.
Характерно, что в инее дейтерия меньше, чем его содержится в обычной воде. Иней образуется из водяного пара, а так как тяжелая вода испаряется медленнее легкой, то пар, содержащийся в воздухе, уже обеднен дейтерием.
Надо отметить, что точное определение количества дейтерия в воде — задача очень сложная. И сложная не только потому, что различие в содержании дейтерия у отдельных образцов очень невелико. Перед проведением анализа необходима самая тщательная очистка воды, а очистить воду, не изменив при этом ее изотопный состав, необычайно трудно. Ведь у кислорода, входящего в состав воды, тоже есть изотопы. При различных операциях во время анализа количество их в воде может меняться.
Изменение плотности воды, вызванное присутствием сбычного количества тяжелых изотопов кислорода, в двенадцать раз больше изменения плотности, вызываемого присутствием в ней дейтерия. А так как количество дейтерия в воде чаще всего определяется именно по ее плотности, то даже небольшое изменение в изотопном составе кислорода может существенно исказить результаты анализа.
Изотопный анализ природных вод дает для науки весьма ценные сведения. Доказано, что вода арктических морей и вода морских льдов отличаются по своему изотопному составу. Эти отличия связаны с водным режимом исследуемой области и условиями образования льдов. Таким образом, проводя изотопный анализ дрейфующих льдов, можно установить место их образования и направление морских течений.
Разный изотопный состав капель дождя и снежинок свидетельствует о том, что возникают они в облаках разными путями.
Сжигая водород в кислороде, выделенном из различных минералов, и исследуя затем изотопный состав полученной воды, удается воссоздать условия образования этих минералов в земной коре.
Все эти работы требуют от исследователя большой изобретательности и экспериментального мастерства. И почти каждый год приносит здесь много нового, порой заставляет пересмотреть старые результаты, наметить и уточнить пути дальнейших исследований.
|
Д |
Ейтерий — верный спутник протия. Там, где есть природная вода или другие водородные соединения, там есть и дейтерий. Естественная смесь этих двух изотопов— водород — принадлежит к числу весьма распространенных химических элементов нашей планеты; по весу его около одного процента. В атмосфере Солнца из ста атомов на долю водорода приходится 81 атом. В межзвездном пространстве атомы водорода встречаются в несколько сот раз чаще, чем атомы всех других химических элементов, вместе взятых.
Водород находится в природе как в виде химических соединений с другими элементами, так и в свободном состоянии. Химически не связанный, свободный водород имеется в газах, выделяющихся при извержении вулканов. Он образуется при разложении некоторых органических веществ, а также выделяется в небольших количествах растениями.
Основная масса водорода, имеющаяся в природе, входит составной частью в молекулы различных химических соединений. Вместе с углеродом и другими элементами водород образует сложные молекулы живых организмов, нефти, природных газов и так далее. Но самым распространенным химическим соединением водорода является его соединение с кислородом— вода. В воде содержится повесу 11,11 процента водорода. При разложении воды его выделяется по объему в два раза больше, чем кислорода. Общее количество воды на Земле, исчисляемое в тоннах, выражается числом с пятнадцатью нулями. Примерно десятую часть от этого количества составляет протий и две стотысячных части — дейтерий. Таким образом, на нашей планететолько в воде содержится несколько десятков миллиардов тонн дейтерия.
Дейтерий может быть выделен из любого вещества, который имеет в своем составе водород. Но так как в сколько - нибудь заметных количествах дейтерий нигде в природе не концентрируется, то для его получения предпочтительнее использовать самое распространенное, легко доступное и дешевое сырье. Это сырье — обычная вода. Из природной воды можно выделить сначала тяжелую воду, а из нее, например, путем разложения электрическим током получить дейтерий. Или, наоборот, сначала выделить дейтерий, а затем, сжигая его в кислороде, получить тяжелую воду.
Но выделить из огромной массы природной воды содержащиеся в ней крохотные количества тяжелой воды очень трудно. Надо переработать тысячу литров воды, чтобы получить всего с полстакана этого драгоценного вещества.
В настоящее время разработано несколько методов получения тяжелой воды и дейтерия из природной воды. Один из них — метод перегонки. Этот метод давно известен и он широко применяется в промышленности для разделения жидких смесей. Поясним его сущность. Если жидкость находится в открытом сосуде, то с поверхности ее происходит испарение. Испарение идет при всякой температуре. По мере нагревания жидкости скорость испарения увеличивается. При температуре, при которой давление пара жидкости становится равным внешнему давлению, испарение происходит уже не только с поверхности, но и в ее толще. Внутри жидкости при этом начинают образовываться пузырьки пара, быстро поднимающиеся вверх. Говорят — жидкость кипит. Любое индивидуальное жидкое рещество имеет вполне определенную, характерную для него температуру кипения. Вода при атмосферном давлении, равном 76 сантиметрам ртутного столба, кипит при 100 грудусах, этиловый спирт—при 78,3, а глицерин—при 290 градусах. При этих температурах давление пара воды, эфира и глицерина равно атмосферному давлению. Пар над кипящей чистой жидкостью имеет тот же химический состав, что и жидкость, из которой он образуется (имеется в виду, что жидкость при кипении не разлагается и не изменяет своего химического состава).
Теперь возьмем две жидкости, например, бензол и толуол. Бензол имеет температуру кипения 80,4 градуса, толуол 110,6 градуса. Смешаем их в равных количествах и нагреем. Такая смесь закипит примерно при 92 градусах. Будем продолжать нагревание пока столбик ртути в термометре не поднимется до 93 градусов. Образующийся при этом пар направим в холодильник, где он сконденсируется снова в жидкость. Это будет первая фракция. Анализ ее показывает, что бензола там содержится уже не 50 процентов, как в исходной смеси, а 70 процентов. Между точками кипения смеси от 93 до 94 градусов можно собрать вторую фракцию; от 94 до ^5 градусов — третью и так
Далее.
Если первую фракцию снова нагреть, то она закипит уже при более низкой температуре — около 87 градусов. Как и в первом случае, сконденсируем пар, образовавшийся при нагреве фракции 87—88 градусов. Собранный после холодильника конденсат содержит бензола уже более 80 процентов и менее пятой части приходится в нем на долю толуола. Повторяя с первой и другими фракциями такие же операции еще несколько раз, в конце-концов можно снова из смеси выделить чистый бензол.
Подобный метод фракционного разделения возможен только при условии, что жидкая смесь и образующийся при ее кипении пар имеют различный состав. Пар должен быгь обогащен молекулами низкокипящего вещества, а кипящая смесь — молекулами высококипящего вещества. Если составы жидкой смеси и насыщенного пара над ней будут одинаковы, то разделение смеси на составляющие ее части путем фракционной перегонки невозможно.
Чтобы ускорить процесс разделения и сделать его непрерывным, на практике используют так называемые фракционные колонны. Принцип действия фракционной колонны состоит в следующем. Внизу такой колонны имеется куб, в котором разделяемая смесь доводится до кипения (рис.7). Из куба пары поступают внутрь колонны и проходят через специальные тарелки, три из которых в крупном масштабе показаны на рис. 9. Тарелки всегда наполнены так называемой флегмой — смесью, состоящей из поступающей сверху колонны свежей, подлежащей разделению жидкости, и жидкости, образующейся за счет частичной конденсации паров, идущих из куба.
Трубки а (рис. 8) покрыты колпачками, края которых погружены в флегму. Поступающие снизу пары должны проходить через флегму. При этом они частично охлаждаются и конденсируются, а флегма нагревается и испаряется. Конденсируется в первую очередь та составная часть паровой смеси, которая имеет более высокую температуру кипения. Испаряется же из флегмы низкокипящая жидкость. Флегма по трубкам Ь стекает вниз.
При достаточной производительности кипятильника и хорошей теплоизоляции колонны специального дополнительного обогрева тарелок не требуется, так как пар, поступающий с нижней тарелки, имеет более высокую температуру, чем темпера? ура кипения флегмы на соседней верхней тарелке, и, кроме того, флегму подогревает теплота, вы-
Деляющаяся при конденсации высококипящей жидкости.
На каждой тарелке идет процесс — пары обедняются
Молекулами высококипящей жидкости, а флегма обога
Щается ими. Чем выше в колонне поднимается пар, тем меньше в нем остается молекул высококипящей жидкости. И наоборот, на нижних тарелках флегма почти не содержит молекул жидкости с низкой, температурой кипения.
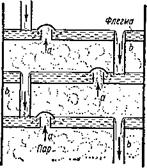 Так во фракционных колоннах осуществляется разделение смеси на составляющие ее жидко -
Так во фракционных колоннах осуществляется разделение смеси на составляющие ее жидко -
Сти. На химических заводах часто отдельные колонны собираются в батареи. В подобных батареях удается произвести разделение жидкостей с весьма близкими температурами кипения. Однако выделить из природной воды чистую тяжелую воду путем перегонки затруднительно. У них, как и у других изотопных веществ, очень близки температуры кипения. Во фракционных колоннах удается лишь
несколько повысить концентрацию тяжелой воды в стекающей вниз флегме.
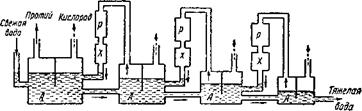
Самый ранний и, по-видимому, лучший метод получения дейтерия —разложение природной водызлектрическим током. Основой этому методу послужило наблюдение Юрэя и Уошбэрна, которые заметили, что тяжелая вода разлагается электрическим током труднее на дейтерий и кислород, чем обычная вода на протий и кислород. Поэтому к концу электролиза в оставшейся жидкости концентрация тяжелой воды должна увеличиваться. В производственных условиях электролиз ведут в специальных ваннах. В них протекают те же процессы, что и в маленьком сосуде, в котором химик разлагает воду при анализе. К погруженным внутрь ванны электродам подводится постоянный (одного направления) электрический ток, достигающий тысячи и более ампер, но малого напряжения (всего 2,5 — 3,5 вольт). В ванну наливается обычная вода. Для повышения ее электропроводности добавляется щелочь. Когда основная масса воды разложится, электролиз прекращают. В небольшом количестве оставшейся после электролиза жидкости концентрация тяжелой воды повышается в несколько раз. Чтобы получить чистую тяжелую воду, надо первоначальный объем воды уменьшить в несколько тысяч раз. Осуществлять такое большое уменьшение объема в одном приборе и в один прием практически нерационально. Подобно тому, как фракционные колонны соединяют в батареи, так из электролизных ванн создаются системы, в которых раствор, последовательно переходя из ванны в ванну, обогащается тяжелой водой.
По мере увеличения концентрации тяжелой воды на электродах наряду с протием выделяется все большее и большее количество дейтерия. Чтобы уменьшить его потери, выделяющуюся смесь изотопов водорода сжигают, а образовавшуюся воду возвращают в предыдущую ванну (рис. 9). Таким образом, на практике одна и та же порция воды многократно подвергается электролизу. Все это связано с большим расходом энергии. На производство одного килограмма тяжелой воды приходится затрачивать свыше 130 ООО киловатт-часов электроэнергии. Этой энергии хватило бы для 100-ваттной электрической лампы на 150 лет непрерывного горения.
Электролизные установки экономически выгодно дополнять специальными колоннами, в которых происходит реакция изотопного обмена между газообразным водородом и водяным паром.
Около 70 лет назад, исходя из представления охимическом равновесии, Д. И. Менделеев писал, что атомы одного и того же химического элемента, входящие в состав разных молекул, могут обмениваться друге другом местами: «если даны частицы АВ и АВ9 то А из первой может переходить во вторую частицу и обратно». Проверить эту гипотезу на опыте было невозможно. Действительно, как проследить за двумя атомами, принадлежащими одному и тому же
|
Рис. 9. Упрощенная схема установки для получения тяжелой воды Электролизом. А — электролизные ванны, Р — аппараты для сжигания водорода, X — холодильники. |
Элементу, если они совершенно одинаковы? Скажем, перед вами раствор едкого натрия в воде:
NaOH и НОН.
Попробуйте докажите, что атом водорода из молекулы щелочи перешел в молекулу воды, а из воды такой же атом перешел в щелочь; или как узнать, что атомы кислорода поменялись в молекулах местами.
Когда стало известно о существовании изотопов, когда научились отличать атомы отдельных изотопов, гипотеза Менделеева стала доступна проверке опытом.
Растворите ту же щелочь, но не в обычной, а в тяжелой воде:
NaOH и DOD.
Если действительно обмен атомами между молекулами происходит, то часть атомов протия из едкой щелочи перейдет в молекулы воды, а дейтерий из воды перейдет в молекулы щелочи. В растворе появятся новые молекулы:
NaOD и HOD,
Наличие которых может быть обнаружено экспериментально. Это и есть реакция изотопного обмена, то есть химическая реакция, при которой изотопы одного итого же элемента, входящие в состав разных молекул, обмениваются друг с другом местами.
Как же практически используются реакции изотопного обмена при получении тяжелой воды?
|
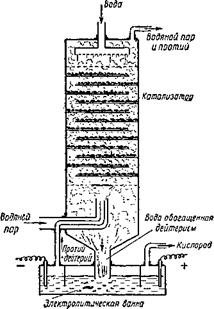
Рис. 10. Схема колонны изотопного обмена. |
Под влиянием катализатора происходит обмен атомов дейтерия между молекулами НЕ) и водородом, входящим в состав молекул воды. Аппарат комбинирует метод электролиза воды с методом газообразного изотопного обмена.
Представьте себе молекулу водорода, состоящую из одного атома протия и одного атома дейтерия (ЬШ), и молекулу пара обычной воды (НОН). При некоторых условиях между молекулами происходит обмен: атом дейтерия переходит в молекулу воды, а один из атомов протия занимает
Место дейтерия в водороде. Обмен атомами изотопов можно записать в виде следующего химического уравнения:
HOH+HD=HOD+H2.
Не следует думать, что все атомы дейтерия, имеющиеся в газе (HD), сразу же при смешении с водяным паром перейдут в молекулы воды (HOD). Практически этого можно достигнуть только в специальных обменных колоннах, работающих по принципу фракционных колонн. Кроме того, здесь необходимо присутствие некоторых веществ (катализаторов), облегчающих течение реакции в желаемом направлении и ускоряющих ее.
На рис. 10 показана схема обменной колонны. В низ такой колонны подается газообразная смесь протия и дейтерия, получающаяся при. электролизе воды. Туда же вдувается водяной пар. Атомы дейтерия сначала переходят в молекулы водяного пара, вытесняя оттуда один атом протия. Затем пар, уже нового изотопного состава, конденсируется. В результате стекающая вниз вода обогащается атомами дейтерия, а освобожденный от них газообразный протий уходит через верх колонны.
До сих пор мы говорили о возможных методах получения тяжелой воды, которая может служить сырьем при производстве дейтерия. Имеется и другой путь получения дейтерия, минуя выделение тяжелой воды. Можно электролизом разложить на водород и кислород всю воду ванны без остатка. Тогда водород будет представлять смесь протия и дейтерия того же состава, что и в природной воде. Теперь остается только разделить изотопы водорода друг от друга. Как это сделать?
Известно, что превращенный в жидкость протий кипит при минус 252,8 градуса, а жидкий дейтерий имеет температуру кипения на три с лишним градуса выше. Различие в температурах кипения жидких изотопов существенно больше, чем у их кислородных соединений, тяжелой и обычной воды. Это обстоятельство открывает возможность разделения изотопов путем перегонки. При нагревании жидкого водорода вначале станет испаряться протий, а дейтерий будет оставаться в сосуде в виде жидкости.
Практическое осуществление такой перегонки связано, однако, с большими техническими затруднениями, так как процесс нужно вести при крайне низких температурах. Нет ли других путей разделения изотопов водорода? Есть.
Смесь изотопов водорода можно подвергнуть «сепарации», подобно тому, как поступают с молоком, когда желают из него выделить сливки. При быстром вращении сосуда - центрифуги более тяжелые составные частицы молока отбрасываются к стенкам, а легкие частицы сливок располагаются ближе к оси вращения. «Сепарация» водородных изотопов из газовой смеси осуществляется не вращением сосуда, а изменением направления полета частиц при воздействии на них электрическим и магнитным полями. Так как эти поля оказывают отклоняющее действие лишь на электрически заряженные частицы, то атомы изотопов должны быть предварительно превращены в ионы; для протия и дейтерия это означает лишить их единственного электрона.
В масс-спектрографе, с которым вы уже знакомы, происходит именно такое, вызванное одновременным действием электрического и магнитного полей, разделение изотопов. Заменяя в масс-спектрографе фотопластинку специальными приемниками, поставленными в тех местах, где собираются изотопы разных масс, можно произвести их разделение.
Различие масс атомов протия и дейтерия позволяет применить для их разделения также метод диффузии (диффузия — латинское слово, означает распространение).
В комнате, где плотно закрыты все окна и двери, воздух неподвижен, спокоен. Но это спокойствие только кажущееся. Если бы мы могли наблюдать отдельные молекулы воздуха, то увидели бы как беспорядочно, по всем направлениям, с самыми различными скоростями они движутся. Тут можно встретить молекулы, летящие как пули, и молекулы, передвигающиеся «черепашьим шагом». Однако, если измерить скорость большого числа молекул, то окажется, что очень быстро и очень медленно движется совсем небольшая доля молекул. Подавляющее большинство их движется со скоростями, мало отличающимися друг от друга. Без большой ошибки можно считать, что все молекулы данного газа движутся с одной и той же средней скоростью.
Какова средняя скорость движения молекул газа?
При одной и той же температуре у различных газов она различна. Так при комнатной температуре средняя скорость движения молекул водорода составляет около 1800 метров в секунду, а азота — 500, кислорода—460 метров в секунду. Учитывая, что молекулярный вес водорода
(вес молекулы газа, отнесенный к веса атома изотопа
кислорода-16) равен 2 «кислородным единицам», азота — 28 и кислорода — 32, легко прийти к выводу: быстрее двигаются молекулы того газа, у которого меньше молекулярный вес.
|
Рис. 11. Через некоторое время в левую половину сосуда через пористую перегородку пройдет большее число молекул водорода, чем азота. Черные кружки •— молекулы азота, белые — молекулы водорода. |
 Когда газ заключен в какой-нибудь сосуд, то его молекулы ударяются о стенки сосуда. Если стенки пористые, некоторым молекулам удастся выйти из сосуда. Явление самопроизвольного проникновения одного вещества в другое при их непосредственном соприкосновении или через пористую перегородку и называется диффузией.
Когда газ заключен в какой-нибудь сосуд, то его молекулы ударяются о стенки сосуда. Если стенки пористые, некоторым молекулам удастся выйти из сосуда. Явление самопроизвольного проникновения одного вещества в другое при их непосредственном соприкосновении или через пористую перегородку и называется диффузией.
Из газовой смеси через пористую перегородку будет диффундировать больше того газа, у которого меньше молекулярный вес. Найдено, что величина скорости диффузии газов обратно пропорциональна корням квадратным из их молекулярных весов.
Поместим в одну из половинок сосуда, разделенного пористой перегородкой на две части (рис. 11), смесь равных объемов газов: азота и водорода, а из другой воздух откачаем. Через некоторое время часть газа продиффундирует через перегородку. Если сделать анализ этого газа, то окажется, что водорода прошло больше, чем азота. Остаток газа в первой половине сосуда, наоборот, будет в процентном отношении содержать больше азота, чем его было в начальной смеси. Происходит частичное разделение газов. Многократно повторяя процесс диффузии через пористую перегородку, удается полностью отделить один газ от другого. Практически разделение тем легче осуществить, чем больше отличаются молекулярные веса газов, составляющие смесь.
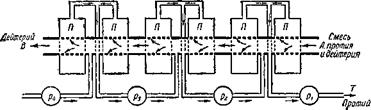
У изотопов разница в молекулярных весах мала и все же их можно разделить методом диффузии. Для этого надо процесс повторить много сотен раз. На рис. 12 приведена часть схемы-установки для непрерывного разделения
изотопов водорода путем диффузии сквозь стенки пористых трубок.
Смесь изотопов проходит по трубе А В справа налево. Двигаясь по пористым участкам трубы, газовые молекулы частично диффундируют и попадают в окружающие эти участки трубы кольцевые пространства Я. Молекул протия пройдет через стенки немного больше, чем молекул дейтерия. Продиффундировавший газ будет несколько обогащен протием, а оставшийся в трубе АВ газ — дейтерием. По мере продвижения газа клевому концу трубы Л В, газ все больше обогащается дейтерием. Одновременно все большее и большее его количество диффундирует через пористые стенки
|
Рис. 12. Часть схемы-установки предназначена для разделения изотопов водорода путем диффузии сквозь пористые стенки. |
Трубы. Чтобы избежать потерь дейтерия, прошедший через пористую стенку газ из Я вновь возвращают в систему на одну ступень ближе к входу. Эту работу выполняют насосы Pi> Р2> Ps и т - Д - При достаточном числе пористых участков из левого конца трубы АВ выходит практически чистый дейтерий, а справа из трубы Т — чистый протий.
Таков вкратце диффузионный метод разделения газообразной смеси на изотопы.
Разделение изотопов возможно также методом термодиффузии. Это интересное явление было открыто сто лет назад, в 1857 году. Если между горячей и холодной стенками сосуда поместить смесь, состоящую из двух различных газов, то однородность состава смеси несколько нарушается: около холодной стенки скапливается один газ, около горячей— другой. Разумеется, разделение газов происходит далеко не полное. Беспорядочное движение молекул стремится снова их перемешать и восстановить однородность смеси по всему объему. Смесь изотопов подобна смеси различных газов. Явление термодиффузии должно наблю -
Даться и в смеси изотопов, но менее ярко. Чтобы добиться более или менее существенного разделения изотопов, процесс термодиффузии надо повторить большое число раз. Теория явления термодиффузии очень сложна.
В последнее время в иностранной печати появились сообщения о том, что в результате исследований, проводимых в Южно-Африканском Союзе и Западной Германии, может быть разработан более дешевый способ получения тяжелой воды. Ожидают, что новый способ получения тяжелой воды приведет к значительному снижению ее стоимости.
Сущность нового способа получения тяжелой воды заключается в том, что тяжелый водород выделяется и концентрируется при некоторых процессах получения нефти из каменного угля. Полученный при таких процессах побочный продукт, богатый тяжелым водородом, можно использовать для производства тяжелой воды.
На этом мы закончим далеко не полное знакомство с возможными методами разделения изотопов. Характерная особенность этих методов — многократное повторение одной и той же операции. Для полного разделения изотопов, например водорода, надо много, много раз повторить или перегонку, или разложение воды электрическим током, или диффузию через пористую перегородку. Только постепенно, переходя от одной операции к другой, удается увеличить концентрацию тяжелого изотопа—дейтерия. Особенно трудно при получении чистого дейтерия освободиться от последних, небольших примесей к нему протия.
На электролиз, подогрев, перекачку больших количеств жидкости и газов при производстве тяжелой воды и дейтерия приходится затрачивать огромные количества энергии. Поэтому стоимость тяжелой воды пока еще весьма высока. И все же, несмотря на очень большие материальные затраты, тяжелую воду получают все в больших и больших количествах, так как она находит теперь очень важное применение.
Где же находит применение тяжелая вода и ее самая ценная составная часть — дейтерий?