НОВОЕ СОДЕРЖАНИЕ СТАРОЙ ГИПОТЕЗЫ
|
П |
Ервые изотопы были обнаружены, как вы только что видели, у радиоактивных элементов, а именно среди членов радиоактивных семейств урана и тория. Но затем были найдены изотопы и у нерадиоактивных элементов. Здесь «охотникам за изотопами» помог очень интересный прибор — масс-спектрограф, созданный английским физиком Астоном. Принцип работы масс-спектрографа основан на взаимодействии движущейся заряженной частицы с электрическим и магнитным полями. Когда заряженная частица пролетает через электрическое или магнитное поле, то возникает сила, отклоняющая частицу от прямолинейного пути. Сила эта тем больше, чем больше величина заряда частицы. Но так как частица имеет массу, то по закону инерции она стремится сохранить направление своего полета неизменным. Поэтому отклонение частицы от прямолинейного пути под действием поля будет прямо пропорционально ее заряду, но обратно пропорционально ее массе. Другими словами, отклонение частицы под действием силы поля зависит от отношения величины заряда к величине массы данной частицы. Мало того, отклонение будет зависеть и от скорости полета самой частицы; причем здесь влияние элекг трического и магнитного полей сказывается по-разному. Отклонение в электрическом поле обратно пропорционально квадрату скорости, а отклонение в магнитном поле обратно пропорционально, просто скорости (без квадрата).
Можно так подобрать направление и величину электрического и магнитного полей, что по выходе из них частицы с различными скоростями, но одинаковыми отношениями величины заряда к массе будут собираться в одном месте,
|
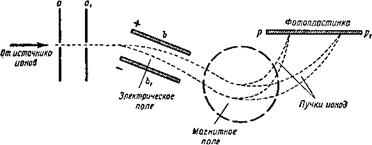
Рис. 6. Схема масс-спектрографа. |
А частицы с другим отношением заряда к массе — в другом. Этого и достиг в своем масс-спектрографе Астон. На рисунке 6 показана схема его прибора.
Астон пропускал через щели а и а1 узкий пучок положительно заряженных атомов — ионов исследуемого химического элемента. Сначала ионы проходят между параллельными пластинами Ь и одна из которых заряжена электричеством положительного знака, другая — электричеством отрицательного знака. Созданное таким образом между пластинами электрическое поле взаимодействует с зарядом летящего иона и отклоняет его вниз. Затем ионы влетают в магнитное поле (область, обозначенная пунктиром), направленное так, что оно вызывает отклонение летящих ионов в противоположном направлении — вверх. По выходе из магнитного поля все ионы с одинаковым отношением заряда к массе оказываются собранными в одном месте. На фотографической пластинке ррх они оставляют изображение щели аг Ионы с другим отношением заряда к массе собираются в другом месте, дают другое. изображение той же щели ах. Расстояние между изображениями щели тем больше, чем больше отличаются отношения зарядов к массам у отдельных ионов. Сколько различных сортов ионов находилось в ионном пучке, столько получается и изображений щели—темных черточек на фотографической пластинке. Возникает своеобразный «спектр масс», или масс-спектрограмма. Так как заряды ионов, выраженные в единицах, равных заряду протона, всегда представляют целые и обычно малые числа (1,2, Зит. д.), то по расстоянию между изображениями щели на фотографии можно вычислить массу иона, а значит, и массу атома данного химического элемента.
В отличие от химических методов, которые дают лишь относительные значения масс атомов, с помощью масс-спектрографа определяются абсолютные значения этих масс. Масс-спектрограф дал возможность найти значение масс атомов в привычных нам единицах веса — граммах. Без преувеличения можно сказать, что изобретение масс - спектрографа позволило взвешивать отдельные атомы на лету.
Исследования с помощью масс-спектрографа показали, что инертный газ неон имеет три изотопа. Обыкновенный хлор является смесью двух изотопов. Имеется четыре сорта (изотопа) атомов серы, десять различных сортов атомов олова и так далее.
Большинство радиоактивных изотопов получено в последние годы искусственным способом. Всего сейчас известно свыше тысячи ста изотопов и в их числе примерно 250 нерадиоактивных. Все эти различного вида атомы размещаются в ста двух клетках периодической таблицы элементов.
Как же объяснить, что атомы изотопов, имея одинаковый заряд ядра, а значит, и одинаковое число протонов в ядре и одинаковое число электронов, вращающихся вокруг ядра, обладают различной массой?
Массу атома определяют не электроны. Они, как мы уже знаем, для этого слишком легки. Причину различия в
Массах изотопов надо искать в самом ядре. При одинаковом числе протонов ядра могут иметь разную массу только в том случае, если в их состав входят еще какие-то частицы, которые не изменяют их электрического заряда. И действительно, теперь установлено, что всякое атомное ядро (кроме ядра протия) составлено из протонов и примерно таких же по массе, но электрически не заряженных частиц-ней - тронов.
В ядрах изотопов при одинаковом числе протонов содержится разное число нейтронов. Ядра трех изотопов неона содержат каждый по 10 протонов и соответственно 10, 11 и 12 нейтронов. Ядро одного изотопа хлора имеет 17 протонов и 18 нейтронов, а у другого изотопа на 17 протонов приходится 20 нейтронов.
Итак, атомы химических элементов построены из трех родов частиц: протонов, нейтронов и электронов. Протоны и нейтроны, составляющие ядро, имеют почти одинаковые массы; по принятой шкале атомных весов они очень близки к единице. А теперь вспомним, что в свое время говорил английский врач Проут. Он утверждал, что все атомы, встречающиеся в природе, построены из атомов водорода и их веса должны быть кратны весу этого атома.
Действительно, точные измерения с помощью масс-спектрографа дают для атомных весов изотопов числа, очень близкие к целым. Но только для изотопов. Атомные веса химических элементов в большинстве — дробные числа. Каждый изотоп хлора в отдельности имеет атомный вес, очень близкий к целому числу:34,9787 и 36,9788, а их естественная смесь, содержащая 75,4 процента первого изотопа и 24,6 процента второго, то есть именно то, что мы называем химическим элементом хлором, имеет атомный вес, сильно отличающийся от целого числа, 35,457. Близкие к целым числам атомные веса можно ожидать только у тех химических элементов, которые в естественном состоянии не представляют смеси устойчивых изотопов (бериллий, фтор, натрий, алюминий и некоторые другие) или когда содержание одного изотопа сильно преобладает над содержанием всех других изотопов, составляющих естественную смесь (гелий, углерод, азот и другие).
Таким образом, целочисленное значение атомных весов изотопов возрождает старую гипотезу Проута, но в нее вкладывается новое содержание, отвечающее современному уровню знаний о строении атомов химических элементов.
Атомные веса изотопов, округленные до целых чисел, принято называть массовыми числами изотопов. Массовое число изотопа равно суммарному числу протонов и нейтронов, составляющих ядро.
Для обозначения изотопов применяют химические обозначения соответствующих элементов. Это обычно первая или первая и какая-либо из последующих букв латинского названия элемента. Цифра, стоящая вверху справа около обозначения элемента, указывает массовое число изотопов; цифра внизу слева — заряд ядра. Например, изотопы хлора записываются так: 17С135 и 17С187; четыре изотопа серы:
С 32 СЗЗ С 34 С36
16° > 1в° * 16° » 16° *
Заряд ядра часто не пишут, так как название элемента
И без того точно указывает клетку, которую занимает элемент в периодической таблице, а следовательно, и заряд ядра и число электронов, вращающихся вокруг него. В дальнейшем изложении мы часто будем вместо обозначения изотопа писа! ъ его русское название, а массовое число указывать цифрой через дефис: хлор-35, сера-34 и так далее.