ТЕХНОЛОГИЯ МИНЕРАЛЬНЫХ УДОБРЕНИЙ
РАСТВОРИМОСТЬ В СИСТЕМЕ KCI—NH4H2P04—Н20
Одним из путей совершенствования производства сложных удобрений из желтого фосфора является получение их полупродуктов, минуя стадию изготовления фосфорной кислоты.
Разработаны методы получения конденсированных фосфатов аммония [1] непосредственным взаимодействием 'Лятиокиси фосфора с аммиаком. Представляется целесообразным исследование аналогичных методов получения н трехкомпонентных удобрений.
|
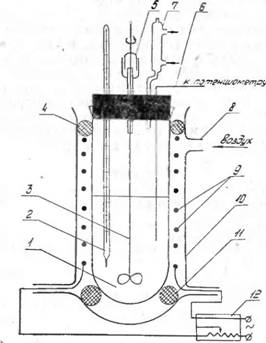
Рис. 1. Схема установки политермического исследования растворимости: 1 — кварцевая пробирка; 2 — контрольный термометр; . 3— мешалка; 4, 11— асбестовое кольцо; 5 — гидрозатвор; 6 — карман сопротивления; 7—обратный холодильник; 8 — штуцер подачи охлаждающего воздуха; 9 — электросцираль; 10 — корпус; 12 — регулятор напряжения |
Для разработки методов производства трехкомпонентных удобрений поглощением пятиокиси фосфора солевыми растворами и расплавами необходимы данные по растворимости в образующихся при этом системах и по скорости поглощения пятиокиси фосфора растворами и расплавами солей.
Растворимость в системах, содержащих KCI, NH4H2PO4, я продукты их конверсии, изучены в ряде работ [2]. Отмечено [3], что в системе KCI—Н3РО4—Н20 при температуре 20—80 °С равновесной твердой фазой является хлорид калия. Политермическим исследованием системы K. CI—KH2P04— ~-Н20 [4] в интервале температур от —10,8 до 35 °С выявлено наличие в данной системе области осаждения твердых растворов монофосфата калия в хлориде. Система NH4H2P04—NH4CI—Н20 простого эвтонического вида [5]. Исследованием системы KCI—NH4H2P04—Н2О при температурах от —11,2 до 35 °С установлено наличие полей кристаллизации твердых растворов: (NH4; К)С1 и (NH4; ЮН2РО4.
Таким образом, данные по растворимости взаимной системы KCI—NH4H2P04—NH4CI—КН2РО4—Н20 при температурах выше 35 °С отсутствуют, тогда как для анализа процесса поглощения паров пятиокиси фосфора растворами солей необходимо знание равновесия в интервале 60—80 °С.
В работе приведены результаты исследования изотермической растворимости в данной системе при 60 °С. Методика изотермического исследования аналогична работе [2]. Данные по растворимости дополнены политермическим исследованием на установке, представленной на рис. 1. Исследуемый раствор заливали в кварцевую пробирку 1 емкостью 150 мл, на поверхности которой закреплена греющая спираль 9. Пробирка 1 закреплена двумя муфтами 4 и 11 из шнурового асбеста в корпусе 10 из термостойкого стекла. Скорость охлаждения пробирки регулируется подачей воздуха в штуцер 8, скорость нагрева — напряжением на спирали. Температура появления и исчезновения кристаллов контролируется капиллярным термометром 2 с точностью ±0,1 °С с параллельной записью потенциометром. Состав системы контролируется по начальным и конечным условиям. Анализ твердой и жидкой фаз осуществляли известными методами [6], КгО — весовым, NH3— отгонкой, Р2О5 — фотоколориметрическим.
Результаты исследования растворимости приведены в таблице.
В изученной системе установлено наличие полей осаждения индивидуальных фосфатов аммония и калия, а также Разделяющего поля осаждения их твердых растворов, отношение К20: NH3 в которых меняется от 0: 1 до 1:0.
|
Состав равновесных фаз во взаимной системе КСІ—N Н4Н2Р04—N Н4С1-КН2Р04-Н20
|
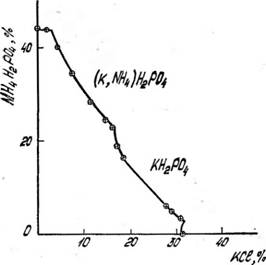
Наличие поля осаждения однозамещенных фосфатов калия подтверждается как существованием значительного излома линии растворимости на изотерме (рис. 2), так и> изменением хода кривой понижения температур кристалли-
|
Рис. 2. Диаграмма растворимости в системе КС1— NH4H2P04—Н20 при температуре 60 °С |
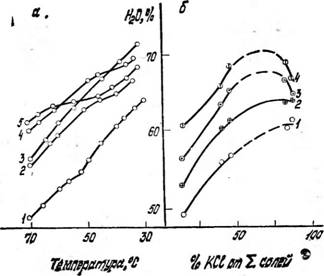
Зации, установленных при политермическом исследовании пяти разрезов системы (рис. 3).
Во всех случаях в составе выделенных осадков присутствие хлорсодержащих солей не установлено. Однако, судя по произведению растворимости хлоридов, следует предположить наличие в данной системе узкого поля осаждения
|
Рис. 3. Зависимость температуры (а) кристаллизации от содержания воды в растворе при доле хлорида калия от суммы всех солей, %: / — 13; 2 — 39; 3 — 45; 4 — 83; 5 — 89; (б) изотермы кристаллизации для температур, °С: 1 — 70; 2 — 60; 3 — 50; 4 — 40 |
Твердых растворов хлоридов (К, NH4), примыкающего к линии равновесной растворимости фосфата калия в области концентраций NH3 в растворе менее 0,5%.
Политермическое исследование растворимости показывает (см. рис. 3, а), что с понижением концентрации суммы солей в растворе на кривой одновременного понижения температур кристаллизации наблюдаются участки экстремальных изменений, характеризующих смену равновесной твердой фазы. Изменение состава данной фазы при содержании 40—45% КС1 от суммы всех солей для температуры 60°С подтверждает наличие на изотерме 60 °С в данной области
точки пересечения линий растворимости (см. рис. 3,6). С увеличением доли КС1 точки перемены состава твердой фазы смещаются в область более низких температур.
Таким образом, при понижении температуры кристаллизации следует ожидать, что поле осаждения твердых растворов будет сужаться с относительным увеличением поля осаждения фосфата калия. Расчеты по данным растворимости показывают, что при получении нитроаммофоски (1:1:1) с использованием КС1 возможно выделение части фосфата (0,15—0,17 т/т нитроаммофоски) в виде КН2РО4 с последующим применением его при приготовлении бесхлорных удобрительных смесей для садоводства и парникового хозяйства.