ТЕХНОЛОГИЯ МИНЕРАЛЬНЫХ УДОБРЕНИЙ
ОСОБЕННОСТИ АЗОТНОКИСЛОТНОГО РАЗЛОЖЕНИЯ КАРАТАУСКИХ ФОСФОРИТОВ
Азотнокислотные методы переработки менее чувствительны по сравнению с сернокислотной экстракцией к качеству и постоянству состава исходного фосфатного сырья и позволяют в одном технологическом процессе совместить разложение фосфатсодержащего минерала с получением комплекс-
ного удобрення, содержащего несколько питательных элементов [1—4].
Особый интерес представляет для отечественной промышленности метод с вымораживанием нитрата кальция, так как он позволяет обеспечить комплексное использование фосфатного сырья при практически полном отсутствии отходов [5, 6].
Имеющиеся сведения о скорости растворения основных минералов, содержащихся в фосфоритах Каратау, не позволяют с достаточной полнотой сделать заключение о целесообразных путях их переработки и, в частности, о путях переработки рядовых фосфатных руд этого месторождения.
В соответствии с этим целью данной работы было изучение особенностей азотнокислотного разложения рядовых каратауских фосфоритов.
Исследование влияния концентрации и нормы азотной кислоты, продолжительности контакта фаз и температуры на степень перехода основных компонентов фосфатного сырья в жидкую фазу проводили на образце фосфорита месторождения Чулактау следующего состава (мае. %): 35,2 СаО, 23,7 Р205, 3,3 MgO, 1.2 Fe203, 0,3 А1203, 18,4 Si02, 6,1 С02 и 21,8 нерастворимого остатка. Опыты проводили в периодических условиях. Фосфорит разлагали азотной кислотой в стеклянном реакторе с мешалкой при интенсивном перемешивании, чтобы сбить обильно образующуюся пену. Через определенные промежутки времени отбирали пробы пульпы для анализа на Р205, Fe203, А1203 и SiOz дифференциальным фотометрическим методом и СаО и MgO комп - лексонометрическим методом.
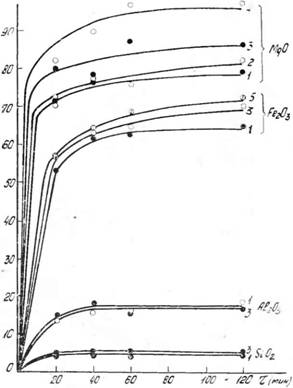
Как показали результаты исследования, разложение рядовой каратауской руды азотной кислотой концентрации 46— 56% HN03 при норме 110 и 130% от стехиометрического количества (в расчете на СаО в сырье) протекает достаточно интенсивно уже при 40—50 °С. Зернистая и оолитово-зерни - стая структура этих фосфоритов, а также наличие в них карбонатов способствует быстрому разрушению фосфатного зерна. Степень извлечения Р205 и СаО из фосфорита в исследуемом диапазоне концентраций и норм азотной кислоты через 40—60 мин составляет 99—100%. С повышением концентрации азотной кислоты от 46,3 до 56,2% HN03 степень извлечения в жидкую фазу магнийсодержащих минералов возрастает (рис. 1). При 50 °С и норме кислоты 130% от стехиометрии (в расчете на СаО) в течение 20 мин степень извле-
Чения MgO в раствор в изучаемом интервале концентраций изменяется соответственно с 71,2 до 79,9%. С удлинением" времени реакции до 120 мин переход MgO в жидкую фазу достигает 80,8 и 86,5% соответственно.
|
Рис. 1. Влияние длительности процесса и концентрации азотной кислоты на степень извлечения примесей из фосфорита в раствор (норма кислоты 130% от стехиометрии, температура—50 °С). Концентрация HN03 (мас. %): 1 — 46,4; 2 — 49,8; 3 — 53,9; 4 — 56,2 |
Изменение нормы кислоты в диапазоне 110—130% не оказывает существенного влияния на извлечение MgO из фосфорита в раствор.
С повышением концентрации азотной кислоты и продолжительности контакта фаз увеличивается и степень перехо
да в раствор соединений железа. Так, при разложении фосфорита кислотой, содержащей 46,3% HN03 при норме 130%,, степень извлечения Fe2Os в течение первых 20 мин составляет 36,9%, а через 60 мин достигает 46,3%. С повышением концентрации кислоты, например до 56,2%, извлечение Fe203 в жидкую фазу тоже растет и за те же промежутки времени составляет соответственно 55,9% и 69%. Увеличение длительности контакта фаз до 2 ч повышает степень перехода Fe2Os в раствор до 72,3%.
Степень перехода окиси алюминия для данного образца фосфорита с повышением концентрации азотной кислоты с 49,8 до 56,9% HNOs изменяется незначительно на 1—2% и составляет 17—19%.
При 50 °С извлечение Si02 в жидкую фазу в течение первых 20 мин разложения фосфорита азотной кислотой в диапазоне концентраций от 46,3 до 60,3% HN03 и норме 130% от стехиометрической составляет 5—6%. С удлинением времени реакции до 2 ч содержание Si02 в растворе немного падает независимо от температуры, концентрации и нормы азотной кислоты, что, вероятно, связано с частичной коагуляцией Si02 в процессе разложения.
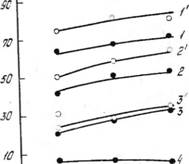
На рис. 2 показано влияние температуры на степень извлечения примесей в раствор при разложении фосфорита азотной кислотой, содержащей 46.3% HN03, взятой в количестве 130% от стехиометрической нормы. Время разложения — 20 мин и 2 ч.
|
Рис. 2. Влияние температуры процесса разложения на степень перехода примесей в раствор при разложении образца каратауского фосфорита азотной кислотой, содержащей 46,5% HN03 при норме 130% от стехиометрии: 1, 2, 3, 4 — нзохроны 20 мин; /', 2', 3', 4' — изохроны 120 мин. |
|
За to so t °С |
С повышением температуры степень перехода MgO и R;Os в раствор увеличивается. Аналогичная зависимость наблюдается для всех рассмотренных концентраций азотной кис юты.
Полученные экспериментальные данные показывают, что степень перехода примесей (MgO и R203) фосфатного сырья зависит от концентрации исходной азотной кислоты и температуры процесса и в значительной степени определяется продолжительностью взаимодействия исходных компонентов.
Сократив продолжительность процесса разложения фосфорита азотной кислотой до 30—40 мин при 40—45 °С, возможно ограничить переход этих примесей в раствор при практически полном извлечении Р205 и СаО в жидкую фазу, что, несомненно, положительно отразится на качестве готового продукта, а именно на содержании Р2О506Щ и Р205усв.