ТЕХНОЛОГИЯ МИНЕРАЛЬНЫХ УДОБРЕНИЙ
О РАСТВОРИМОСТИ ОКИСЛОВ АЗОТА ТРИБУТИЛФОСФАТОМ
В последние годы для поглощения окислов азота предлагают использовать ряд органических веществ: алкилсуль - фоксиды, диалкиламиды, алкилфосфорамиды, алкилфосфаты и др. [1—0]. Однако имеющиеся сведения крайне ограничены [10—1Ц и не позволяют в полной мере оценить возможности и перспективность практического их использования. Наибольший интерес представляет, по нашему мнению, три- бутиловый эфир фосфорной кислоты (трибутилфосфат, ТБФ), имеющий широкое применение как экстрагент.
Ниже приведены результаты исследования растворимости NOje в трибутилфосфате в широком интервале изменения физико-химических условий (парциальном давлении окислов азота до 0,95-105 Па, степени окисленности до 98%, температуры от 0 до 70°С). Исследование растворимости проводили динамическим методом с контролем достижения состояния насыщения по неизменности общей кислотности жидкой фазы в течение 1,5—2 ч. Для анализа состава нитрозного газа использовали методику [12]. Опыты ставились при атмосферном давлении.
Результаты исследования свидетельствуют о большой емкости трибутилфосфата по отношению к окислам азота. Растворимость окислов азота в ТБФ в значительной мере определяется концентрацией окислов азота в нитрозном газе и степенью их окисленности (рис. 1). В исследованных условиях общая кислотность раствора в состоянии насыщения достигала более 90 мае. % / в пересчете на азотную • 2 кислоту. Следует заметить, что под общей кислотностью раствора понимается содержание в жидкой фазе растворенных соединений азота, определенное ацидимет - рическим титрованием, в пересчете на HN03.

|
Рнс. 1. Влияние парциального давления окислов азота на равновесное содержание их в трибутилфосфате. Степень окисления окислов азота. % (температура, °С): /—90(0), 2 — 75(0); 3 — 50(0); 4 —90(20); 5 — 75(20); 6 — 35(20) |
Трибутилфосфат преимущественно растворяет высшие окислы азота N204 (NOz) , что под - 0,6 QS тверждается увеличением Концентрация 'окисюё азотаобщей кислотности раствора, например, с 14 до 42 мае. % при изменении степени окисленности окислов азота с 35 до 90% и использовании для насыщения нитрозного газа с концентрацией окислов 20 об. % при 20°С. В отличие от известных поглотителей [13], например концентрированной азотной кислоты, большая растворимость окислов азота наблюдается и при значительном содержании в нитрозном газе окиси азота. Так, при поглощении нитрозных газов с концентрацией высших окислов азота 21 об. % увеличение концентрации N0 с 14,5 до 50 об. % приводит к росту общей кислотности с 39 до 48 мае. % в пересчете на HN03 при 20 °С. Отдувка окислов азота инертным газом показала наличие в жидкой фазе не более 2,5 мае. % HN03. Указанные факты свидетельствуют о растворимости в ТБФ не только высших окислов азота, но и трехокиси азота, что подтверждается
превышением количества г-экв, растворенных окислов азота в единице массы раствора, определенного оксидиметрически, над количеством г-мол по ацидиметрии. Кроме того, растворение низших форм окислов азота в ТБФ подтверждено изучением электронных спектров насыщенных растворов, характеризующихся наличием максимума поглощения в области 670 нм, т. е. в области поглощения N203.
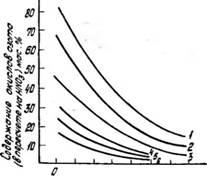
Процесс поглощения окислов азота трибутилфосфатом термически обратим, о чем свидетельствует существенное влияние температуры на растворимость окислов &
Азота (рис. 2). Повышение температуры от 0 до 70 °С приводит к уменьшению растворимости окислов азота в зависимости от условии в 4— 8 раз. Полученные данные характеризуют температуру как одну из важнейших характеристик для регулирования процессов поглощения окислов азота ТБФ.
|
№ го 30 40 SO SO 70 Температура,"С |
|
Рис. 2. Влияние температуры на растворимость окислов азота в трибу - тилфосфате. Парциальное давление окислов азота, Па (степень нх окис - ленности, %); /-0,6-106 (90); 2 — 0,4-105 (90); 3 — 0,4-105(50); 4 — 0,1 • 105(90); 5 — 0,1 • 105(50); 6 — 0,1 • Ю5 (25) |
|
Et ■ |
|
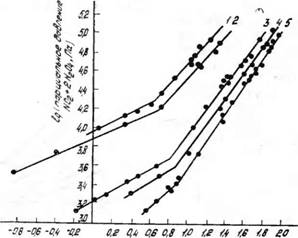
Рис. 3. Зависимость логарифма парциального давлення N02+2N204 от логарифма концентрации N02 в жидкой фазе при температурах: 1 — 50; 2 — 40; 3 — 20; 4 — 10; 5 — 0 |
|
Fy /концентрация , м&с.%> |
|
Проведенная математическая обработка экспериментальных данных позволила получить, например, полиномиальную модель процесса для температур 273—343 К{Т), содержания в жидкой фазе азотной кислоты до 2,5 мае. % (СК), концентрации NOx в газовой фазе 0,1—0,9 моль долей (Р), степени окисленности окислов азота 15—100% (а): С0бщ= 1,685 • 102+4,535 • 102Р+4,308а—1,747 • Т— — 1,464 - С/С+0,493 • Р ■ а— 1,466 • Р • Т— 1,701 • Р ■ СК— — 1,413 • 10"2 • а • Т—1,054 • 10~2 • а • СЯ+6,657 • 10-3 - СК-7+- +8,322- 10"2-Р2—1,264- 10-4-а2+4,108- 10-3-Г2+ +4,124- 10~2-СД2, |
Непрямолинейный характер зависимости общей кислотности насыщенных растворов от концентрации нитрозного газа (см. рис. 1) указывает на наличие взаимодействий между компонентами жидкой фазы. При обработке экспериментальных данных обнаружены изломы прямых зависимостей логарифма концентрации высших окислов в растворе от логарифма концентрации N02(N204) в газовой фазе (рис. 3) при всех исследованных температурах, что свидетельствует о различном механизме растворения окислов азота, о различной природе связей в определенных концентрационных интервалах. Учитывая большую склонность ТБФ к сольватообразо - ванию, по-видимому, следует рассматривать возможность образования комплексов типа ТБФ-/гЫ02(К204) до полноты насыщения валентных связей поглотителя, а дальнейшее растворение окислов азота происходит в соответствии с законами фазового растворения. Закономерности процесса растворения NOx в ТБФ не подчиняются закону Генри, а являются] более сложными, нежели как трактуется в [14] . Следует указать, что, по нашему мнению, данные [14] по растворимости N02 в ТБФ явно занижены.
Где Собщ — содержание соединений азота в насыщенном растворе в пересчете на HN03 (мас. %), определенное ацидиметрически.
Погрешность расчетов по приведенному уравнению ± 5 отн. % .при степени надежности 0 95.
Таким образом, экспериментальные данные свидетельствуют о большой емкости трибутилфосфата по отношению к окислам азота, причем ТБФ способен поглощать не только N02(N204), но и значительные количества N2C>3. Термическая обратимость процесса указывает на перспективность использования трибутилфосфата для концентрирования ни - трозных газов.