ТЕХНОЛОГИЯ МИНЕРАЛЬНЫХ УДОБРЕНИЙ
ИССЛЕДОВАНИЕ РАВНОВЕСИЯ НИТРОЗНОГО ГАЗА С РАСТВОРАМИ АЗОТНОЙ КИСЛОТЫ ПРИ ПОНИЖЕННЫХ ТЕМПЕРАТУРАХ И НИЗКИХ КОНЦЕНТРАЦИЯХ ОКИСЛОВ АЗОТА
Для решения многих задач в технологии азотной кислоты нужны достаточно объективные и полные сведения о равновесии окислов азота с растворами азотной кислоты, охватывающие широкий диапазон условий. С целью получения таких данных были проведены углубленные теоретические и экспериментальные исследования системы окислы азота — растворы азотной кислоты |Т—4]. Эти исследования позволили по-новому объяснить многие вопросы, касающиеся равновесия в данной системе, получить новые важные данные о равновесном составе жидкой фазы. Однако в указанных работах равновесие изучено в диапазоне параметров, не охватывающем все возможные области изменения технологических условий в процессах переработки окислов азота в азотную кислоту. Поэтому было целесообразно продолжить эти исследования с применением новой, усовершенствованной методологии, с целью получения более полных, надежных и объективных данных.
Исследование равновесия между окислами азота и растворами азотной кислоты проводили при 0, 10, 30 и 40 °С в диапазоне изменения нитрозности газа от 1,5 до 5 об. % и степени окисления от 5 до 95% при постоянном давлений (атмосферном). Исследования проводили динамическим методом. описанным в работе [5]. Анализ жидкой фазы проводили по [2—4]. Результаты экспериментов представлены tta рисунках 1—7.
Полученные зависимости равновесной концентрации азотной кислоты от общей нитрозности газа, степени его окисления и температуры согласуются с известными ранее данны-
|
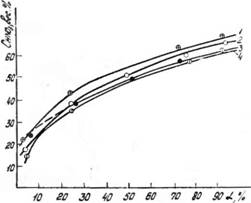
Рис. 1. Зависимость концентрации азотной кислоты от степени окисления нитрозного газа. Температура, °С /—О, 2—10; 3 — 30; 4 — 40; Рцо+1ЧО,=°>05 а™ |
Ми — концентрация кислоты тем выше, чем больше нитроз - ность газа, степень его окисления и чем ниже температура. На рис. 1. показана зависимость концентрации азотной кислоты от а для температур 0, 10, 30, 40 °С. При Pno+no2 ~ ~0,05 атм. и 40 °С увеличение а от 5 до 90% приводит к повышению равновесной концентрации от 15,6 до 62,7% HN03. Снижение температуры от 40 до 0°С при а=80% приводит к повышению концентрации кислоты на 2,5—4%. Влияние температуры на равновесную концентрацию азотной кислоты Можно видеть также на рис. 2.
Заметим, что при невысокой нитрозности газа, равной но при высокой его степени окисленностн а=92ч - "^94% можно получить азотную кислоту концентрацией вы-
В связи с тем, что процесс кислотообразования происходит в основном в жидкой фазе представляют большой интерес подробные данные о равновесном составе жидкой фазы, g работах [2—4] приведены результаты исследований по этому вопросу. Однако данных о равновесном содержании окислов азота в растворах азотной кислоты для указанных диапазонов нитрозности и температуры в литературе не имеется.
Полученные в настоящей работе данные свидетельствуют о том, что существует определенная взаимосвязь между парциальными давлениями N0 и N02 в газовой фазе и их содержанием в растворе.
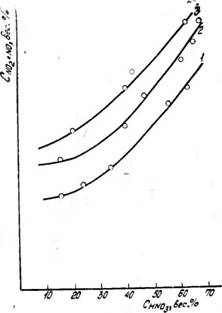
С увеличением парциального давления N02 в газе увеличивается концентрация CN02 в растворе. На рис. 3 видно, что Cm увеличивается с увеличением концентрации HN03 для газа постоянной нитрозности. Это связано с тем, что при постоянной нитрозности концентрация HN03 возрастает вследствие увеличения парциального давления двуокиси азота в нитрозном газе. Концентрация окиси азота в жидкой фазе также возрастает с увеличением Рno в нитрозном газе. Зависимость Cno=/(Chnoii) представлена на рис. 4. Снижение Cno с увеличением концентрации HN03 связано с тем, что при pno+no2=const увеличение концентрации кислоты соответствует понижению Рта о в газовой фазе.
В исследованных условиях растворимость N02 в растворах азотной кислоты значительно превышает растворимость N0. Поэтому суммарная концентрация окислов азота в жидкости (Cno+no2) будет возрастать с увеличением концентрации HN03 при постоянной нитрозности газа (рис. 5). На суммарную растворимость большее влияние будет оказывать увеличение содержания двуокиси азота с увеличением Рмоа в газе по сравнению с уменьшением Cno в жидкой фазе за счет уменьшения Рмо в газовой фазе.
Чтобы исследовать зависимость равновесного содержания N0 и N02 в жидкой фазе от концентрации азотной кислоты при постоянных значениях Pno и Pno2> были рассчитаны величины
^NO, CN0o
И no2 = 7г— •
Noa
Величины //no и //no3 характеризуют удельную растворимость окиси и двуокиси азота в растворах азотной кислоты.
|
Рис. 5. Зависимость суммарной концентрации окислов азота в жидкой фазе от концентрации азотной кислоты. ^NO+NOj—0.05 атм. Температура, °С: / — 0; 2- 10; 3-40 |
|
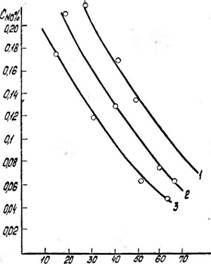
Рис. 4. Зависимость концентрации N0 в жидкой фазе от концентрации азотной кислоты. PNO+NO;i = 0,05 атм. Температура, °С: / —0; 2—10; 3 — 40 |
|
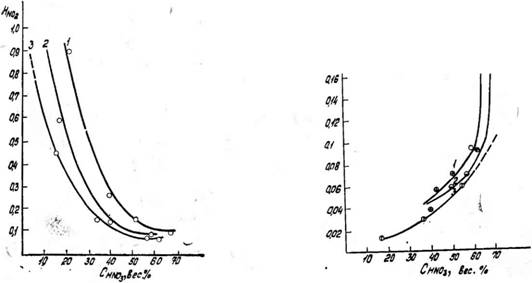
Рис. 7. Удельная растворимость окиси азота в растворах азотной киело - гы. PNo+no,=0'05 атм- Температура, °С: / — 0; 2-10; 3-40 |
Рис. 6. Зависимость удельной растворимости двуокиси азота от концентрации азотной кислоты. PNO+NOj=0,05 атм. Температура,°С: / — 0; 2— 10; 3— 40
Из графиков, представленных на рис. 6 и 7, можно видеть, что величина Н no увеличивается, а величина Ико уменьшается с ростом концентрации HN03. При этом в области высоких концентраций азотной кислоты удельная растворимость N0 резко возрастает, а удельная растворимость N02 резко уменьшается. Такими зависимостями //no, и //no от концентрации азотной кислоты можно объяснить сложность получения азотной кислоты повышенной концентрации.
Действительно, получить крепкую азотную кислоту (более 65—68%) можно либо при условии значительного увеличения парциального давления N02 в газе либо при условии очень малого содержания N0 в газе. В противном случае равновесие реакции
ЗК02+Н20^2Н\0з+\'0
Будет сдвинуто влево в результате значительного увеличения концентрации N0 в - растворе крепкой азотной кислоты либо' вследствие понижения концентрации N02.