Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
ХЛОРИД БАРИЯ
Из многих способов получения хлорида бария74 наибольшее промышленное распространение получили солянокислотный и хлоркальциевый способы. Хлорнатриевый, хлораммониевый, хлор - магниевый, хлорный и другие способы получения хлорида бария не имеют широкого применения, хотя некоторые из них в определенных условиях используются или могут быть эффективно использованы.
Солянокислотный способ. В основе этОго способа лежит реакция: BaS + 2НС1 = ВаС12 + H2S
Охлажденный плав сернистого бария размалывают в шаровой или трубчатой мельнице и направляют на разложение соляной кислотой. При размоле плава в мельницах мокрого помола выгружаемый из печи плав не охлаждается, а поступает по желобу в Мельницу, в которую подается вода или слабый щелок в количестве, достаточном для образования густой шламообразной массы. При этом отпадает необходимость в улавливании вредной пыли и уменьшаются потери от окисления плава воздухом.
Разложение плава соляной кислотой производят в стальных, реакторах, футерованных кислотоупорным кирпичом или диабазовой плиткой в два слоя. Подачу плава в соляную кислоту производят в течение 1,5—2 ч при перемешивании реакционной массы до тех пор, пока раствор не приобретет щелочную реакцию, при содержании 18—20 г избыточного BaS в 1 to. Это приводит к осаЖдению из раствора примеси железа
FeCl2 + BaS = FeS + BaCl,
И других тяжелых металлов. ...
Для полного разложения кислоторастворимых соединений (ВаБОз, ВаСОз, силикатов бария) и для того чтобы выделяющаяся при разложении силикатов кремневая кислота не переходила в раствор, используют соляную кислоту с концентрацией не ниже 13% НС1, лучше 15% НС1. Применение более концентрированной кислоты нежелательно, так как это способствует выделению элементарной серы, теряемой с отвалом.
По окончании разложения в реактор добавляют горячие промывные воды для разжижения реакционной массы с целью ускорения отстаивания раствора от нерастворимых компонентов плава и в особенности от тонкодисперсного илистого осадка сернистого железа. После отстаивания осадка раствор декантируют, оставшийся шлам, содержащий до 5% ВаС12 • 2Н20, промывают горячей водой (~80°). Полученные при промывке шлама слабые растворы хлористого бария используют для следующих промывок, для разжижения реакционной массы перед отстаиванием и для мокрого помола плава сернистого бария. Шлам после промывки смывают струей воды и отправляют по желобу в отвал.
Запатентована75 непрерывно действующая установка для разложения раствора BaS соляной кислотой, состоящая из двух последовательно включенных реакторов. Первый из них представляет, собой трубу, в которой смешиваются растворы, а второй — резервуар, разделенный на две камеры вертикальной перегородкой, не доходящей до крышки; реакционная смесь поступает в нижнюю зону одной камеры, а удаляется из другой.
Отделение щелоков от шлама и промывку его производят тгк - же на центрифугах, добавляя предварительно к пульпе древесные опилки, что облегчает отжим илистого осадка. Отделенный от шлама щелок для освобождения от взвешенных частиц пропускают через фильтр-пресс и направляют в стальной закрытый. резервуар с мешалкой, где щелок нейтрализуют соляной кислот, оГ:. Для удаления растворенного сероводорода щелок продувают острым паром. Полученный чистый раствор, содержащий 260—300 г/л ВаС12, смешивают с маточными щелоками, оставшимися после кристаллизации, и подвергают выпариванию до концентрации 400—600 г/л ВаС12, а затем при охлаждении до 25—35° кристаллизуют ВаС12-2Н20. Иногда выпаривают только маточные щелоки, которые затем сливают с чистым раствором, полученным после выщелачивания, и смешанный щелок направляют на кристаллизацию. На современных заводах солянокислотное разложение пульпы сульфида бария ведут непрерывным способом в каскаде реакторов. Затем шлам отделяют с помощью автоматических
фильтрпрессов76. Выпарку растворов хлористого бария осуществляют в многокорпусных вакуум-выпарных аппаратах. Температура кипения раствора в первом корпусе равна 105—106°; в последнем— около 65°. Иногда выпаривание в вакуум-аппаратах совмещают с кристаллизацией.
Кристаллизацию часто осуществляют в непрерывно действующих кристаллизаторах, имеющих форму желоба с двойными стенками, между которыми циркулирует охлаждающая вода. Длина желоба 16 м, ширина 1,5 м, высота 0,5 м. Раствор течет по желобу противотоком охлаждающей воде. Выпадающие на дно желоба
С помощью механических гребков к концу кристаллизатора и сваливаются в приемник, из которого поступают на центрифугу. Для кристаллизации применяют также барабанные кристаллизаторы с воздушным охлаждением.
Отжатый на центрифугах от маточного раствора кристаллический хлористый барий промывают водой. Кристаллы, выгружаемые из центрифуги» содержат обычно не более 4% гигроскопической влаги и укупориваются в бочки. Иногда продукт подвергают сушке горячим воздухом (110—120°) в барабанных вращающихся сушилках для понижения содержания гигроскопической влаги до 1%.
При получении хлористого бария описанным солянокислотным способом на 1 т 97%-ного ВаС12-2Н20 расходуют: 1,25—1,35 г барита (100% BaS04), 0,4—0,5 г реакционного угля (7000 ккал/кг) И 1,4—1,6 т 27,5%-ной соляной кислоты. В качестве отхода на каждую тонну хлористого бария из реактора удаляется 0,11— 0,13 т сероводорода, который перерабатывают на элементарную серу, сернистый газ (серную кислоту), гидросульфид или тиосульфат натрия и пр. Вследствие ядовитости сероводорода должны быть обеспечены условия, препятствующие его проникновению в производственные помещения; предельно допустимая концентрация H2S в воздухе рабочей зоны 0,01 мг/л.
|
Кристаллы передвигаются
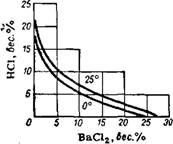
Рис. 137. Растворимость в сиСтеме ВаС12—НС1—Н20. |
Выделение кристаллов хлористого бария из щелока может быть произведено высаливанием путем добавления к щелоку соляной кислоты. Растворимость ВаС12 в воде при 25° равна 27,1%. В растворе, содержащем 21,66% НС1, растворимость его понижается до 0,1% (рис. 137). При смешении равных объемов ~27%-ного раствора НС1 и насыщенного при 25° раствора ВаС12 выкристаллизуется около 86% соли. При повышении температуры эффективность высаливания увеличивается. Для уменьшения содержания
Кислоты в кристаллическом осадке кислоту следует добавлять медленно при 60°. Затем кристаллы отмывают от кислоты двухкратной промывкой нейтральным раствором хлористого бария. Оставшийся после высаливания кислый щелок (соляную кислоту с примесью - ВаС12) направляют на разложение плава сернистого бария.
В солянокислотном способе получения хлористого бария соляная кислота может быть частично заменена поваренной солью 77-79. При этом разложение плава сернистого бария производится уменьшенным в 2 раза количеством соляной кислоты по реакцию
2BaS + 2НС1 = ВаС12 + Ba(HS)2
Из полученного гидросуль-> фидного щелока — раствора гидросульфида и хлорида бария — хлооид бария высаливается поваренной солью: ВаС12 + Ba(HS)2 + 2NaCl 4- 2Н20 =
= 2ВаС12 • 2Н20 + 2NaHS
Одновременно получается гидросульфид натрия без затраты едкого натра.
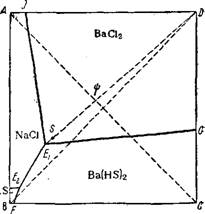
При обработке водной суспензии плава сульфида бария, Ри: 138_ Схема диаграммы раствори - Нагретой до 70 , рассчитан- мости для системы Ba(HS)2 + 2NaCi^ Ным количеством соляной кис- =BaCl2 + 2NaHS При 20°.
Лоты можно получить гидросульфидный щелок любой концентрации вплоть до насыщенного хлоридом бария раствора. Несмотря на уменьшенное количество соляной кислоты, растворение плава происходит быстро, так как равновесие
BaS (тв.) BaS (раств.) Ba(HS)2+Ва(ОН)2
Сдвинуто вправо вследствие нейтрализации ионов ОН- соляной кислотой.
|
|
На схеме диаграммы растворимости водной системы Ba(HS)2-F; [+ 2NaCl = ВаС12 + 2NaHS При 20° (рис. 138) видно, что поле кристаллизации хлористого бария занимает большую часть квадрата и что точка Ei Совместного существования NaCl, Ba(HS)2 И ВаС12*2Н20 является инконгруэнтной. Наибольший выход кристаллического хлористого бария получится в случае кристаллизации по лучу DEi. Фигуративные точки комплексов, получающихся
смешением Ba(HS)2 И NaCl, Лежат на диагонали АС. Следовательно, наивыгоднейший состав исходной смеси Ba(HS)2 И NaCl Будет изображаться точкой г|), лежащей на пересечении диагонали и луча кристаллизации. Введение в систему хлористого бария сдвинет положение точки исходной смеси к точке D И путь кристаллизации удлинится, что является признаком увеличения выхода кристаллов.
Если процесс вести, применяя растворы, не содержащие ВаС12, т. е. при начальном составе системы, изображаемом точкой г|з, то, согласно диаграмме, молярное соотношение 2NaCl : Ва(HS)2 Равно 0,54 : 0,46 (при содержании в исходном растворе 9,5 моль воды на 1 моль суммы солей). Для устранения совместной кристаллизации NaCl И Ba(HS)2 Конец пути кристаллизации не должен доходить до точки ЕЬ оканчиваясь вблизи ее, например, в точке S.
Для получения раствора состава точки г|з необходимо исходить из 35°/о раствора гидросульфида бария. Даже насыщенный сероводородом при 100° раствор сульфида бария не даст раствора гидросульфида такой концентрации. Однако такой раствор, содержащий 35% Ba(HS)2 При 90°, можно получить, если выщелачивать плав сульфида бария не водой, а раствором гидросульфида бария'. Необходимый же для выщелачивания раствор гидросульфида бария можно получить, насыщая раствор BaS Сероводородом.
Для соблюдения оптимального соотношения необходимо ввести в 1 кг 35% раствора гидросульфида бария 0,234 кг поваренной соли. При этом выход ВаС12 • 2Н20 в твердую фазу при охлажде - дии смеси до 20° достигает 72,6%.
Сероводород, необходимый для предварительного получения раствора гидросульфида бария, может быть получен, например, по реакции
NaHS + NaHC03 = Na2C03 + H2S
Из. маточного раствора после кристаллизации хлористого бария. Остающийся в этом растворе ВаС12 (27,4% от начального количества) можно предварительно осаждать содой, образующейся по указанной реакции, что приводит к получению второго продукта — углекислого бария. Из 1 т барита по такой схеме можно получить •0,34 т хлористого и 0,36 т углекислого бария.
Разложение BaS Раствором СаС12 и карбонизацией
Разработаны методы получения гидросульфидного щелока и из него хлористого бария и без применения (или с очень малым расходом) соляной кислоты80,81. Так, например, можно производить высаливание ВаС12-2Н20 (до 70%) при 30—40° 32% раствором. СаС12 из гидросульфидного щелока [около 28% ВаС12 + Ba(HS)2], Получаемого при выщелачивании плава сернистого бария 10% раствором СаС12 при 60—100°. Остающийся маточный раствор используют для выщелачивания новых порций плава.
Можно также производить полукарбонизацию суспензии сульфида бария. При этом по реакции
2BaS + Н20 + С02 = ВаС03 + Ba(HS)2
Получаются карбонат и гидросульфид бария в равных количествах. Однако образующийся раствор Ba(HS)2 Имеет низкую концентрацию и требует выпарки. При многократном, например, трехкратном, выщелачивании плава и карбонизации суспензии, с использованием растворов для повторного выщелачивания плава можно получить раствор с содержанием 27% Ba(HS)2. Такая концентрация достаточна для высаливания хлорида бария поваренной солью с выходом не меньше 75%. Остальные 25% бария можно осадить в виде карбоната или сульфата81.
Способ получения хлористого бария карбонизацией углекислым газом раствора, содержащего эквивалентные количества BaS И СаС12
BaS + СаС12 4- С02 + Н20 = ВаС12 + СаС03 + H2S
Не нашел применения из-за больших потерь бария в форме ВаС03, образующегося наряду с СаС03 (по-видимому, в виде двойного соединения — барито-кальцита). Этого можно избежать, если подвергнуть карбонизации щелок, получаемый после выщелачивания плава сернистого бария раствором хлористого кальция и отделения выпавшего осадка гидрата окиси кальция24:
2BaS 4- 2СаС12 4- 2Н20 = ВаС12 4- Ba(HS)2 + СаС12 4- Са(ОН)2 ВаС12 4- Ba(HS)2 4- СаС12 4- Н20 4- С02 = 2ВаС12 + СаС03 4- 2H2S
При содержании в растворе избытка СаС12 [150% от стехиометрического по отношению к Ba(HS)2] Потери бария в шламе СаС03 весьма невелики. Из получаемого раствора, содержащего ВаС12 и некоторое количество СаС12, после выпарки кристаллизуют ВаС12 - •2Н20. По этой схеме расход С02 на карбонизацию в 2 Pasa Меньше, чем при, карбонизации щелока без отделения Са(ОН)з.
Хлораммониевый способ
Производство хлористого бария может быть экономично организовано в комбинации с регенерацией аммиака из хлористого аммония, содержащегося в жидкости теплообменника дистилляции содовых заводов 82-84:
BaS + 2NH4C1 = ВаС12 + 2NH3 4- H2S
При этом для образования хлористого бария используется отбросный ион хлора содового производства (вместо ценных материалов— НС1 или СаС12) и, кроме того, аммиак регенерируется
С помощью BaS, А не Са(ОН)2. В результате этого затраты на производство ВаС12 оказываются меньше на 20—30%.
Попутно, кроме ВаС12, могут быть получены и другие товарные продукты—сульфид аммония, гидросульфид натрия, сера, серная к'йслота. Это позволяет комплексно использовать сырье, применяемое для получения хлористого бария и соды. Однако масштабы потребления хлористого бария значительно меньше масштабов содового производства.
Жидкость теплообменника дистилляции имеет состав (в %): NaCl —5,8, Na2S04 —0,2, NH4C1—14, (NH4)2C03 — 0,24, свободного NH3~2 И остальное вода. Предварительно в специальной колонне отгоняют из жидкости свободный аммиак. Взаимодействие плава BaS С жидкостью теплообменника дистилляции должно производиться при температуре не ниже 95° и при 5—7%-ном избытке BaS От стехиометрического количества. Это обеспечивает полную отгонку аммиака и сероводорода и получение раствора, не содержащего ионов HS", Присутствие которых снижает степень использования бария и приводит к загрязнению продукта. Отгонка связанного аммиака этим методом, происходит примерно в 5 раз медленнее, чем при обработке жидкости известковым молоком. Осветленный раствор, содержащий около 17% ВаС12, 5,5—6% NaCl И 0,6% СаС12, направляют на вакуум-выпарку, в процессе которой происходит кристаллизация хлористого бария, завершающаяся при охлаждении выпаренного раствора до 20°. Выпаренный раствор, направляемый на охлаждение, содержит (в %): ВаС12— 13,7, NaCl —20,9, СаС12 —0,12. Маточный раствор, полученный после кристаллизации охлаждением, содержит приблизительно 3,5% ВаС12, 25% NaCl И 2,4% СаС12. ■*>
Для возврата аммиака в содовое производство отгоняемая па - •ро-газовая смесь должна быть промыта раствором NaOH, Прпчем сероводород связывается в гидросульфид.
Карбонатный способ
-Этот способ получения хлористого бария является по существу •видоизменением солянокислотного способа. Он заключается в растворении в соляной кислоте природного витерита или ВаС03, осажденного из раствора BaS (или других растворов, содержащих Ва2+): BaS + Н20 + С02 = ВаСОз + H2S ВаС03 + 2НС1 = ВаС12 + Н20 + С02
При использовании природного ВаС03 получение из него хлористого бария отличается большой простотой, дающей преимущества перед другими способами. При необходимости получать углекислый барий осаждением из BaS Экономичность метода сильно понижается. Его преимуществом перед описанным выше солянокис- лотным методом является лишь то, что продукт получается более чистым, так как при осаждении ВаС03 все растворимые примеси, содержавшиеся в плаве сернистого бария, остаются в растворе и растворению в соляной кислоте подвергают чистый ВаС03.
Хлормагниевый способ 24
При взаимодействии BaS С раствором MgCl2 При нагреваний идет реакция:
BaS + MgCl2 + 2Н20 = ВаС12 + Mg(OH)2 + H2S
Используя отход калийной промышленности — щелока хлористого магния, можно при этом получить три ценных продукта — хлористый барий, сероводород и гидроокись магния, которая может быть переработана на окись магния. Эта реакция, однако, долго не могла найти промышленного применения из-за трудности отстаивания, фильтрации и промывки получающегося коллоидального осадка гидроокиси магния.
Вследствие гидролиза BaS В водных растворах при сливании растворов BaS И MgCl2 Протекает реакция:
2BaS + MgCl2 + 2Н20 = Ba(HS)2 + ВаС12 + Mg(OH)2
Наличие в растворе значительного количества ионов ОН- ведет к мгновенному выделению нерастворимого, вязкого, не отстаивающегося осадка Mg(OH)2. По мере его образования происходит дальнейшее гидролитическое расщепление BaS До полного его исчезновения. Активность ионов ОН~ в растворе определяется произведением растворимости [Mg2+] [ОН~]2 = /Садон),- Так как Кнго — = [Н+][ОН"], то
Ку 2О
Принимая, что [Mg2+] = FMg2+CMg2+ (где FMg2+ - коэффициент активности, A CMgs+ — Концентрация ионов магния), имеем:
„ ^Mg(OH)2 Гн+12
Mg2+~ К20FHg»
Приняв для упрощения FMg2+= 1 и логарифмируя, получим:
1GCMg- = lgV(0H,2-21^H20 + 21^H+1
При 20° /См5(0н)2 = 1,2 • КГ11 и Кп2о = Ю-14; подставив эти значения в последнее уравнение и меняя знаки для перехода к величине рН, имеем # PMg2+ = 2PH-17,08
Где PMg2+— логарифм концентрации ионов магния (в г-ионах/л), Взятый с отрицательным знаком.
Пользуясь этим равенством, легко вычислить максимально возМожное содержание Mg2+ (в г/л) в растворах с различным значе-" нием рН при насыщении гидроокисью:
РН..................... 8 9..................... 10 11 12
Содержание Mg8+, Г/л. . . . 2,92-102 2,92 2,92 - Ю-2 2,92 • 10~4 2,92 • 10~"
Эти данные показывают, что при рН < 9 раствор может содержать достаточное количество Mg2+, Не выделяя его в виде гидроокиси. Понижение рН среды или, что то же, уменьшение количества ионов ОН" может быть достигнуто путем предварительного насыщения сероводородом раствора сернистого бария для превращения его в Ba(HS)2. При приливании к такому раствору MgCl2 Осадка не образуется. При постепенном нагревании раствора, содержащего Ba(HS)2 И MgCl2, В силу повышения равновесного давления H2S Последний медленно удаляется; одновременно с этим концентрация ОН" медленно нарастает и происходит выделение хорошо Отстаивающегося и отфильтровываемого осадка гидроокиси магния.
Вместо раствора сернистого бария, получаемого при выщелачивании плава сернистого бария водой, можно пользоваться гидросульфидным щелоком, образующимся при выщелачивании плава BaS Раствором СаС12 по реакции:
2BaS + СаС12 + 2Н20 = Ba(HS)2 + ВаС12 + Са(ОН)г
Образующийся при этом Са(ОН)2 выпадает в осадок и его отделяют, а раствор насыщают сероводородом до требуемой величины рН и сливают с раствором хлористого магния. Выщелачивание плава сернистого бария растворами СаС12 позволяет получить растворы с высокой концентрацией бария. Плав сернистого бария подвергают выщелачиванию при 65° 10% раствором СаС12, количество которого берут с таким расчетом, чтобы перевести весь BaS, Содержащийся в плаве, в Ba(HS)2 И обеспечить добавочное извлечение бария из карбоната и силиката бария в виде ВаС12. Для этой цели шлам, оставшийся после выщелачивания, дополнительно разваривают при 100°.
Отстоявшийся щелок, содержащий 12—13% Ba(HS)2, 15—16% ВаС12 и 0,5—1,5% СаС12, поступает на реакцию с MgCl2 В аппарат колонного типа. В верхней части колонны происходит донасыщение стекающего вниз щелока поднимающимся кверху отходящим сероводородом с доведением рН раствора до 8—8,5. Ниже поступает 30—35%-ный раствор MgCl2 В количестве 125—150% от стехиометрического по отношению к Ba(HS)2. При нагревании раствора по мере прохождения его вниз по колонне от 60 до 100° происходит постепенное удаление H2S И выделение Mg(OH)2. Остатки H2S Удаляют кипячением раствора в нижней части колонны при 103— 104°. Горячий раствор ВаС12 с осадком Mg(OH)2 Поступает на отстаивание и фильтрацию на вакуум-фильтрах. Прозрачный раствор ВаС12 идет на вакуум-выпарку и кристаллизацию, а маточные щелоки после кристаллизации возвращают в производство.
Получение раствора хлористого бария менее высокой концентрации, чем по описанному способу, осуществляют по более простой схеме. Раствор сернистого бария в воде насыщают сероводородом. К полученному гидросульфидному раствору добавляют хлормагниевый щелок. При нагревании этой смеси из нее удаляется сероводород, частично возвращаемый вновь на насыщение исходного раствора BaS, И выделяется осадок Mg(OH)2. После отделения осадка остается раствор ВаС12. Расходные коэффициенты на 1 т 97%-ного ВаС12-2Н20 составляют: 1,14 т барита (100% BaS04), 0,29 т СаС12 (100%), 0,19 т MgCl2 (100%) и 0,34 т реакционного угля (7000 ккал/кг); в качестве побочных продуктов получают 0,13г сероводорода (100%) и 0,08 г MgO (100%).
Этот способ заключается в обработке газообразным хлором раствора, полученного водным выщелачиванием плава сернистого бария 85-87. Суммарная реакция процесса имеет вид:
BaS + С12 = ВаС12 + S
Вследствие гидролиза сернистого бария и хлора образуются промежуточные соединения: Ва(ОН)2, Ba(HS)2, HCl, НС10, Ва(С10)2. Помимо этого, в процессе хлорирования протекают многочисленные побочные реакции, ведущие к образованию некоторых количеств BaS04, BaS203 И других соединений, что понижает выход хлористого бария и серы. Наибольшие выходы ВаС12 и свободной серы достигаются при хлорировании раствора, содержащего около 170 г/л BaS, При 85—90°. При этом выход ВаС12 равен 95%, а серы — 90%- Необходимую температуру поддерживают теплом, Выделяющимся в процессе хлорирования (при начальной температуре раствора 90°).
Избыток хлора ведет к образованию большего количества BaS04, Уменьшая выход ВаС12 и серы:
ВаС12 + S + ЗС12 + 4Н20 = BaS04 + 8HCI
Кроме того, перехлорирование щелока до кислой реакции вызывает коррозию стальных аппаратов и трубопроводов, применяемых в дальнейших стадиях переработки раствора хлористого бария. Поэтому хлорирование ведется до нейтральной или слабощелочной реакций (до обесцвечивания щелока, имеющего желто-зеленый цвет)-. Содержание BaS В прохлорированном щелоке не должно превышать 0,5—1 г/л.
Хлорирование ведут в керамических резервуарах или в башнях, или в другой аппаратуре, устойчивой по отношению к влажному хлору. Прохлорированные щелоки продувают воздухом для удаления растворенных газов (сероводорода, хлора) и направляют на •отстаивание от серы. При содержании в них более 0,5% BaS Последний осаждают раствором хлорного железа в виде FeS. Щелок, отстоявшийся от тонкого осадка серы и сернистого железа, подвергают переработке на кристаллический хлористый барий (выпариванию, кристаллизации, сушке) теми же методами, как и в Других способах, описанных выше. Отвал, оставшийся после водного выщелачивания плава сернистого бария, обрабатывают соляной кислотой для извлечения бария, содержащегося в виде кисло - торастворимых соединений, и промывают водой. Полученные слабые растворы хлористого бария присоединяют к основному раствору поступающему на хлорирование. На производство 1 г 97%-ного ВаС12 • 2Н20 расходуют: 1,25—1,35 г барита (100% BaS04), 0,31 — 0,32 т хлора (100%), 0,1—0,12 т соляной кислоты (27,5% НС1), '0,4—0,5 г реакционного угля (7000 ккал/кг)-, в качестве побочного ■продукта получается 0,12 г серы (100%).
Способы горячего хлорирования и гидрохлорирования
Разработаны способы получения хлористого бария из сухого плава сернистого бария действием на него газообразного хлора «ли хлористой серы при высоких температурах:
BaS + Cl2 = BaCI2 + S BaS + S2C12 = ВаС12 + 3S
Применение этих способов затрудняется сильной коррозией ■аппаратуры хлором и хлористой серой 85-87.
Показана возможность получения ВаС12 хлорированием BaSO- ■в расплаве хлоридов, например, в расплаве ВаС12, в присутствии ■восстановителя (кокса). Растворенный в хлориде сульфат бария вначале восстанавливается до BaS03 Или до BaS И эти продукты восстановления хлорируются. Процесс идет с достаточной интен- •сивностью уже при 800°. Можно получить плав, содержащий до "94% ВаС12 88. На одном из индийских заводов хлористый барий •получают пропусканием хлора или хлористого водорода через раскаленную до 600° шихту, состоящую из барита и кокса. Попутным продуктом является сера89. Взаимодействие барита с хлористым - водородом90-92
BaSO, + 2НС1 = ВаС12 + Н20 + S02 + «/гОз
Резко ускоряется выше 600°, особенно при осуществлении его во Взвешенном слое и с увеличением концентрации НС1 в применяе - •мом газе.
Взаимодействие BaS04 И СаС12
Константа равновесия реакции
BaS04+CaCl2 CaS04+BaCl2
В водной среде определяется отношением произведений раствори - мости BaS04 И CaS04: Кр = ПРВа304: ПРСа504 = СВа2, : При
25° NPBaso4 = 9,9 • 10"U,NPcaso4 = 6,3- Ю-5 и Др я* 1,6. ю-6. Таким образом, в водном растворе при не очень больших концентрациях СаС12 и низких температурах концентрация ионов бария ничтожно мала по сравнению с концентрацией ионов кальция и равновесие реакции сдвинуто влево.
Но если обрабатывать BaS04 Концентрированным водным раствором СаС12при повышенных температурах, эта реакция протекает слева направо. Это обусловлено уменьшением растворимости CaS04 И увеличением растворимости BaS04 При повышении температуры, а также малой растворимостью CaS04 И ВаС12 в концентрированных растворах СаС12, имеющих высокую температуру кипения. Кроме того, с повышением температуры быстро возрастает активность СаС12. Поэтому, обрабатывая BaS04 Концентрированным раствором СаС12, можно получить ВаС12. Так, после 2—3-часовой выдержки при 170° выход ВаС12 составляет ~90%. Он возрастает с увеличением избытка СаС12 и уменьшением количества поды в реакционной смеси. Поэтому извлечь ВаС12 из реакционной смеси выщелачиванием «одой невозможно — реакция пройдет в обратном направлении. Предложено экстрагировать ВаС12 из этой смеси метанолом93. При сплавлении безводной смеси BaS04 И СаС12 сульфат кальция образуется в неактивной, слабо раствоРимой форме94. Это позволяет осуществить выщелачивание ВаС12 не только метанолом, но и воюй, которая успевает извлечь ВаС12 раньше, чем неактивный CaS04 Вступит в реакиию.
Возможность обменного разложения между расплавленными BaS04 И СаС]2 в условиях, когда реакция идет с достаточной для практических целей скоростью, определяется равновесием:
BaS04 (ж.) + СаС12 (ж.) = CaS04 (ж.) + ВаС12 (ж.)
Т, » ,, fCaS04l [ВаС121
Константа равновесия этой реакци лр = | [СаС1 ] ' где ве"
Личины в скобках — активности. Ввиду отсутствия для этой системы данных о степенях ионизации и о коэффициентах активности, можно допустить, что активности пропорциональны молярным долям и распада на ионы не происходит95. Молярные доли N в равновесной системе при степени превращения BaS04 В ВаС12, равной «г,"и при исходном составе смеси щ молей BaS04 И п2 молей СаС1г
|
Будут: |
|
Mi-*) BaS04 + П2 |
|
^ВаС12 |
|
Я, |
|
П1 + «j П,х |
|
Th-J4X_. |
|
^CaS04 |
|
N, |
|
СаС12 щ + П2 ' |
|
П, + «2 |
Подставив эти значения в выражение для КР и обозначив отношение СаСЬ: BaS04 В исходной смеси, т. е. п2: П, через /о, получим:
TliX2_____ _______ X2
(L-X)(N2-NlX) (-х)(г0~х)
Отсюда:
(г0 + 1)/Ср ± [(/Q +1)УР-4(КР - 1)
2(КР-1)
Значения КР можно вычислить из уравнений изменения изобарного потенциала:
Д2°= — RT In Кр И AZ° = AH-T AS
Если принять для всех компонентов, участвующих в реакции, жидкое состояние в качестве стандартного, то уравнения функций АН = F(T) И Д2° = F'(T) Будут такими:
АН = 9777 - 2,73Г + 3,68 • 10-3Г2 4- 1,57 • 1033—1 - AZ" = 9777 - 6,297 lg Г + 3,68 • 10_3Г2 - 0,785 • 105Г-1 + 12,75Г
При 1144° к (871° С) —AZ° = 7129 кал и КР = 22,9. Это дает при г0 = 1 значение х = 0,823 и при г0 = 2 * = 0,965. Таким образом, при 870° возможно превращение BaS04 В ВаС12 на 82,3% в стехио - метрической смеси и на 96,6% при двукратном избытке СаСЬ - Эти вычисленные величины хорошо подтверждаются экспериментальными данными93. При 870° степень превращения BaS04 В ВаС12 при г0 = 1 оказалась равной 82,9%, а при г0 = 298,2%.
|
Х = |
Присутствие в смеси BaS04 И безводного СаС12 плавней (NaCl, КС1 и пр.) значительно ускоряет реакцию при низких температурах. Так, синтетический BaS04, Взаимодействуя с эквивалентным количеством СаС12, при 500° за 28 мин превращается в ВаС12 на 48%, а в присутствии в смеси 9 вес.% NaCl —На 79%, причем NaCl Не является хлорирующим агентом. Аналогичные результаты получаются и с природным баритом. Интенсифицирующее действие плавня проявляется в интервале температур, в котором присутствие плавня вызывает появление жидкой фазы, т. е. 500—600°. Нижний предел этого интервала (500°) соответствует эвтектике NaCl И СаС12 (505°, 51.5 мол. % СаС12)л )а затем тройной эвтектике, температура которой на 5—10° ниже, а верхний предел (605°) —эвтектике СаС12 и ВаС12. При использовании в качестве плавня Ca(N03)2 Жидкая фаза появляется уже при 409°. Оптимальным является небольшое количество добавки, обеспечивающее появление в реак
Ционной смеси всего 10—-15 вес. % жидкой фазы, что позволяет вести процесс при относительно низкой температуре, сохраняя сыПучесть реакционной массы. При более высоких температурах добавка плавня не имеет смысла, так как жидкая фаза появляется и в смесях, не содержащих плавня. Так, уже при 600° в отсутствие плавня степень превращения в лабораторных условиях при разных молярных соотношениях СаС12 : BaS04 Достигает следующих
Величин:
TOC o "1-3" h z CaCl2:BaS04 ............................................ 1,6 1,3 1,0 0,9 0,8 0,7 0,6
I 33 13 мин 87,3 83,9 78,7 76,7 70,3 66,3 55,4
Степень превращения. | ^ 43 95,8 92,9 89,2 86,3 80,1 69,8 60,2
Степень превращения за 43 мин, при соотношениях СаС12: : BaS04, Равных 0,8—0,6, достигает теоретических пределов.
На практике рассмотренную выше реакцию BaS04 + СаС12 ^Zt CaS04 + ВаС12
Осуществляют, прокаливая компоненты в присутствии восстановителя— угля для восстановления сульфатов в сульфиды. А так как растворимость BaS Значительно больше, чем CaS, Растворимость которого при 20° всего около 0,2 г/л, то при выщелачивании плава обратная реакция не идет.
Взаимодействие BaS04 С СаС12 и углем, лежащее в основе хлор - кальциевого способа получения ВаС12, известного также под названием способа Дюфло, является сложным процессом, состоящим из многих реакций, протекающих с разной скоростью. Наряду с основными реакциями обменного разложения BaS04 И СаС12 и восстановления CaS04
BaS04 + СаС12 = CaS04 + ВаС12 + 7,8 ккал
_______ CaS04 + ЗС = CaS + 2СО + С02 - 80,2 ккал________
BaS04 + ЗС + СаС12 = ВаС12 + CaS + 2СО + С02 - 72,4 ккал
Идут приводящие к тем же результатам реакции восстановления BaS04 И обменного разложения BaS И СаС12:
BaS04 + 4С = BaS + 4СО - 138,3 ккал
______ BaS + СаС12 = ВаС12 + CaS + 24,9 ккал
BaS04 + 4С + СаС12 = ВаС12 + CaS + 4СО - 113,4 ккал
Степень перехода BaS04 В ВаС12 и скорость процесса зависят от качества барита, от дисперсности компонентов и состава шихты, от температуры и др.96-98- Примеси, содержащиеся в низкосорт - ком сырье, образуют побочные продукты, обволакивающие зерна BaS04- И препятствующие взаимодействию их с хлористым кальцием и углем. Поэтому степень перехода BaS04 В ВаС12 возрастает с увеличением содержания BaS04 В барите и с ростом молярного отношения CaCl2:BaS04. Повышение температуры до 1100" резко интенсифицирует процесс. Дальнейшее повышение температуры до 1200° приводит к некоторому снижению выхода хлористого бария, очевидно вследствие значительного роста доли побочных реакций. По этой же причине уменьшается степень перехода BaS04 Е ВаС12 при значительном увеличении длительности прокалки шихты. Применение мелкоизмельченных барита и угля (—0,15 мм) Приводит к увеличению выхода ВаСЬ, сокращению длительности процесса и, следовательно, к увеличению производительности печей. (Однако высказывалось мнение, что измельчение барита не обязательно, так как кусковой барит при нагревании до ~250° растрескивается и рассыпается — см. стр. 431.) Консистенция плава обусловлена главным образом содержанием в нем ВаС12 и СаС1а. При переработке барита, содержащего 95% BaS04, Подвижная масса, легко выгружаемая из печи, получается при 10%-ном избытке СаС12 (выход ВаС12 91%). Из низкокачественных руд, содержащих 57—79% BaS04, Можно получить достаточно подвижный плав лишь при применении большого избытка (~20%) хлористого кальция. Выход хлористого бария при этом составляет 88—91%. Однако плавы, полученные из низкосортных баритов, отличаются после охлаждения повышенной плотностью и труднее поддаются выщелачиванию. Кроме того, содержание в них большого количества СаС12 приводит к увеличению потерь ВаС12 с отбросным маточным раствором при кристаллизации. В общем же, примеси, содержащиеся в сырье, значительно меньше влияют на процесс восстановления барита в присутствии СаС12, чем без него.
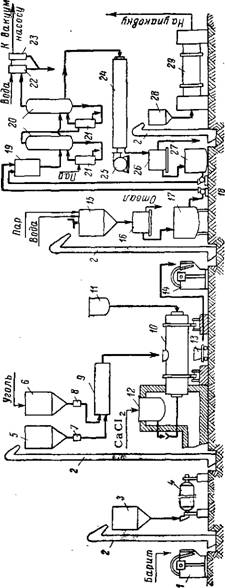
Схема получения хлористого бария хлоркальциевым способом изображена на рис. 139. Прокаливание реакционной смеси ведется в периодически действующих коротких барабанных вращающихся печах (тамбурах), расположенных горизонтально. Топливом служит мазут, подаваемый в печь форсункой. Длина печи 6—7 м, внутренний диаметр 1,5 м; толщина огнеупорной футеровки 250 мм; Число оборотов печи— 1,6 в 1 мин. Полезный объем печи 3,6—5 ж3. В средней части барабана имеется люк, через который производится загрузка шихты и выгрузка плава. Для загрузки барабан Поворачивают люком кверху, для выгрузки — люком книзу.
В печь загружают 1,5—2 т барита, измельченного до 0,5—5 мм, И уголь в количестве 13—15% (в пересчете на углерод) от веса барита. Загрузка длится 10 мин, после чего люк закрывают; печь приводится во вращение и из резервуара, обогреваемого отходящими из печи газами, через трубу, входящую в заднюю горловину печи, в течение 30—40 мин подают концентрированный раствор хлористого кальция, содержащий 800—900 г/л СаС12. Обогрев резервуара с раствором хлористого кальция требуется во избежание Кристаллизации последнего. Количество хлористого кальция (в пе-
|
|
Ф
15 М. В. Познн
Ресчете на 100%), загружаемого в печь, составляет 48—49% от веса барита. Требуемый раствор хлористого кальция получают выпариванием в вакуум-выпарных аппаратах дистиллерной жидкости содового производства (содержащей ^—-100 г/л СаС12) или маточных щелоков, получаемых в качестве отхода в производстве бертолетовой соли (содержащих ~400 г/л СаС12).
В течение 1,5—2 ч после загрузки температуру в печи поддерживают на уровне 770—780°—происходит испарение влаги и шихта превращается в расплавленную массу. Затем температуру повышают до 900—950° — расплавленная масса сильно пенится; через 1—1,5 ч реакция заканчивается. К концу процесса температуру повышают до 1000—1100°, происходит усадка массы, она становится однородной. Температура отходящих газов колеблется ют 200 до 800° (в среднем 300—400°). Длительность одной операции плавки 4—5 ч. Она зависит от количества загруженной шихты, качества сырья, тонкости его помола. Передержка плава в печи, помимо снижения содержания в нем ВаС12, приводит к его загу - стеванию, что может вызвать козлообразование и затрудняет последующее выщелачивание плава.
Когда плав готов, вращение печи прекращают, поворачивают ее люком книзу и в течение 5 мин сливают плав в находящийся под печью плоский чугунный резервуар («паром») или в передвижные тигли, ковши, установленные на вагонетках. Здесь плав застывает в течение 1,5—3 ч (в зависимости от его качества и температуры плава и окружающего воздуха). Плав содержит 55—• 60% ВаС12, 4—12% СаС12, около 7% CaS, Около 3% BaS04, Около 0,5% BaS, 20—25% других примесей — непрореагировавшего угля (6—8%), ВаСОз, FeS, Si02 И проч. Выход хлористого бария в плаве составляет около 90% от теоретического по отношению к загруженному бариту. Остывший плав разбивают на куски, дробят на щековой дробилке до крупности меньше 3 см и направляют на выщелачивание.
Выщелачивание плава производят горячей водой (60—80°). Повышенную температуру в процессе выщелачивания поддерживают острым паром. Применяют выщелачиватели различных типов — резервуары с мешалками на вертикальном валу, желобы с лопаст - йыми мешалками на горизонтальном валу, барабанные вращающиеся выщелачиватели и др.
После выщелачивания раствор отделяют от шлама на центрифугах. Шлам промывают водой и выбрасывают в отвал. Он содержит более 20% CaS, 8—<10% BaS04 И другие нерастворимые вещества, а также 18—(20% влаги и около 1% ВаС12. Количество отвала составляет 0,8—1,1 г на 1 г готового продукта. Промывные воды с центрифуг смешивают с основным раствором. Раствор, содержащий 300—350 г/л ВаС12, отстаивается от мути и поступает на выпарку и кристаллизацию хлористого бария.
Нитрат бария
Маточные щелоки после кристаллизации хлористого бария содержат в среднем 80—120 г/л ВаС12 и 100—150 г/л СаС12. Их присоединяют к раствору, идущему на выпарку. Постепенно содержание в них СаС12 повышается, а содержание ВаС12 понижается, так как хлористый кальций обладает большей растворимостью и высаливает ВаС12 (рис. 132). Когда содержание ВаС12 в маточных щелоках снижается до 25—50 г/л ВаС12-2Н20, они выводятся из никла и выбрасываются.
На 1 т хлористого бария (94% ВаС12-2Н20), получаемого хлоркальциевым способом, расходуется 1,07—1,08 т барита (100%). 0,35—0,38 г топлива (7000 ккал/кг), 0,53—0,70 т хлористого кальция (100%), 2,7—2,8 мгкал пара, 54 квт-ч электроэнергии.
Для осуществления непрерывного выщелачивания плава предложено его предварительно отверждать на охлаждаемой поверхности в тонком слое".
Преимуществом хлоркальциевого метода получения хлористого бария перед солянокислотным является большая простота процесса, так как в одну стадию обжига получается плав хлористого бария, причем различные примеси — соединения железа, Si02, CaS И другие при выщелачивании не переходят в раствор, что исключает необходимость специальной очистки раствора.
Серьезным недостатком хлоркальциевого метода является применение печей периодического действия. Попытки осуществить процесс в непрерывно действующих вращающихся печах пока не дали положительных результатов в связи с сильным приплавлением шихты к футеровке печи. Другим недостатком хлоркальциевого метода является потеря серы с уходящим в отвал сернистым кальцием.