Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
СУЛЬФАТ АЛЮМИНИЯ И ПРОДУКТЫ НА ЕГО ОСНОВЕ
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Сульфат алюминия Al2(S04)3 безводный представляет собой белые кристаллы, имеющие плотность 2,71 г/см3. Растворимость при 0° равна 31,2, при 100° 89 г в 100 г воды. Из водного раствора кристаллизуются бесцветные моноклинные кристаллы A12(S04)3-
• 18Н20, имеющие плотность 1,69 г/см3 (17°) и обезвоживающиеся при 86,5°.
Алюминиевые квасцы имеют общую формулу M2S04* Al2(S04h' -24Н20 или MA1(S04)2- 12Н20.
Алюмо-аммониевые квасцы NH4A1(S04)2-12Н20 — бесцветные кристаллы с плотностью 1,64 г/см3, плавятся при 93,5° без разложения. При нагревании расплавленной массы до 120° отщепляются 10 молекул воды, а при 200° происходит полное обезвоживание. Растворимость при 0° равна 2,6 г, при 80° 35,2 г NH4A1(S04)2-
• 12НгО в 100 г воды.
Алюмо-калиевые квасцы КА1 (S04)2• 12Н20 — бесцветные кристаллы с плотностью 1,76 г/см3, плавятся при 92°. Растворимость при 0° — 2,96, при 20° —5,75, при 70° —35,9, при 90°—109. при 100°—154 г KA1(S04)2 в 100 г воды. Безводный сульфат алюминия-калия KA1(S04)2 гигроскопичен, на воздухе расплывается, имеет плотность 2,75 г/см3.
Алюмо-натриевые квасцы NaAl(S04)2- 12Н20 — бесцветные кристаллы с плотностью 1,675 г/см3, плавятся при 61°. Растворимость при 0° —37,4, при 20° —40,8, при 40°—44,3 г NaAl(S04)2 в 100 г воды. В системе Na2S04—A12(S04)3—Н20 при 0° эвтонический раствор состава (в вес.%): 3,74 —Na2S04 и 21,58 — A12(S04)3 находится в равновесии с твердыми фазами: Na2S04 и инконгруэнтно растворимых квасцов Na2S04 • A12(S04)3 • 24H2Q. Точке перехода соответствует состав раствора 1% Na2S04 и 27,12% A12(S04)3, рав - -
Новесный с твердыми фазами Na2S04- A12(S04)3-24H20 и A12(S04)3- 18Н20'.
При взаимодействии сульфата алюминия с содержащимися в естественных водах бикарбонатами кальция и магния образуется гидроокись алюминия, которая является коагулирующим агентом. В результате гидролиза2'3 сульфата алюминия из водных растворов вначале выделяются промежуточные основные соли, а затем гидроокись алюминия:
A12(S04:, + 2Н20 = A12(S04)2(0H)2 + H2S04 A12(S04)2(0H)2 + 2H20 = A12(S04)(0H)4 + H2S04 A12(S04)(0H)4 + 2H2Q = 2А1(ОН)З + H2S04 A12(S04)3 + 6H20 = 2А1(ОН)з + 3H2S04
Гидролиз A12(S04)3 даже при высоких температурах в интервале 200—300° (при повышенном давлении) протекает с малой скоростью и не превышает 50%. При добавке 15 г/л О Na2S04 гидролиз значитель - I но ускоряется. В получаю - ^ щемся основном сульфате § алюминия содержится до <з 3% Na20. *
По другим данным4, продуктом гидролиза
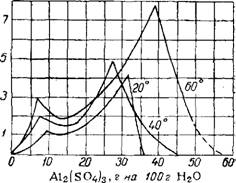
A12(S04)3 при повышенных § температурах и давлении ~ является основной сульфат < состава ЗА1203 • 4S03 • 7Н20, выход которого возрастает при увеличении давления до рис. i8o. растворимость в системе 70 ат и продолжительности А1(ОН)3—A12(S04)3—И20.
Процесса до 30 мин5.
Основной сульфат А1203• 4S03-ЗН20 изоморфен с NH4A1(S04)2- • и, вероятно, имеет структуру, отвечающую формуле [А1 (S04)2]0H3. Соединение ЗА1203 • 4S03 • 9Н20 переходит при определенных условиях в ЗА1203 • 4S03 • (NH4) 20 • 6Н20 б.
|
|
Основные соединения алюминия образуют истинные или коллоидные растворы в воде7, весьма нестойкие. С течением времени или при повышении температуры они разлагаются с образованием осадка переменного состава8, превращающегося в устойчивый комплексный ион [А1.х(0Н)у(Н20)г](3:>:-?')+. В системе А1(ОН)3— A12(S04)3 — Н20 (рис. 180) 9 образуются твердые фазы: 4А1203- ' • 3S03 • 24Н20 — при разбавлении водой, так называемый гидролитический осадок (с 75% щелочности), ЗА1203• 4ЭОз ■ 31Н20 — растворимый осадок, медленно выделяющийся ниже 56° (с 55,6%!
Щелочности), А1203• S03• 3,5Н20 — нерастворимый осадок, выделяющийся при кипячении раствора (66,7% щелочности), и ЗА1203- - 5S03 • R20 • ЮН20 (где R—Na, К, NH4) — откладывающийся в виде накипи при кипячении в присутствии щелочных солей (55,6% щелочности). Под щелочностью здесь имеется в виду отношение количества алюминия в виде А1(ОН)3 к общему его количеству. - Стойкость растворов основного сульфата алюминия зависит от способа их приготовления. Наиболее стойкие растворы образуются при обработке растворов сульфата алюминия водной суспензией мела или известняка при кипячении.
|
До 610° » 810° » '910° |
Начало разложения A12(S04)3 при нагревании наблюдается при 530°. Заканчивается оно при 860°, причем продуктом разложения является у-А120310. Процесс интенсифицируется добавкой 5—10% Fe203 или Сг203 и особенно в восстановительной среде, например в потоке окиси углерода и. По другим данным 12, разложение сульфата алюминия при нагревании идет по следующим стадиям:
A12(s04)3=S03 + A120(S04)2 А120(304)2=02+А120(80,)2 A120(S03)2 = 2S02+A1203
Термохимическое разложение сульфата алюминия представляет интерес для переработки алунита 13. Образующийся при этом глинозем обладает высокой активностью и способностью к спеканию, вследствие большой дисперсности и дефектности кристаллов14. Аналогично протекает и термическое разложение сульфитов алюминия
При обжиге во взвешенном слое обезвоживание основных алю - мо-аммониевых квасцов происходит при 460—520°, а выделение окислов серы при нагревании до — 1100°. При 1000° в течение 5,5- минутного обжига получается продукт, содержащий 90% А1203, а в течение 12-минутного — 95% А1203. Максимальная концентрация окислов серы в лабораторных условиях была 14,5% 16-
Продукты термического разложения различных солей алюминия отличаются разной удельной поверхностью и активностью. Продукт разложения A12(S04)3 при 400—700° имеет удельную поверхность 20—25 м2/г, продукт разложения А1С13 в тех же условиях— 80—160 м2/г, а продукт разложения A1(N03)3 — 100— 170 м2/г 17.
ПРИМЕНЕНИЕ
Сульфат алюминия является наиболее распространенным коагулянтом, применяемым в водоочистке для обработки питьевых и промышленных вод, и используется в ряде других отраслей техники. Коагулирующие свойства A12(S04)3 обусловлены образованием коллоидной гидроокиси алюминия и основных сульфатов в результате гидролиза. В процессе коагуляции А1(ОН)3 коллоидные
Частицы примесеи, находящиеся в воде, захватываются и выдеЛяются вместе с А1(ОН)3 в виде студенистых хлопьев. После химиЧеской обработки воду фильтруют.
Помимо водоочистки сернокислый глинозем применяется в больших количествах в целлюлозно-бумажной промышленности для проклейки бумаги и других целей; его используют в текстильной промышленности в качестве протравы при крашении хлопчатобумажных, шерстяных и шелковых тканей, при дублении кож, для консервирования дерева, в производстве древесно-волокнистых плит, в промышленности искусственных волокон и др.
Алюмо-калиевые квасцы применяют в мясной, кожевенной, текстильной промышленности, в меньших количествах — в меховой, фармацевтической и проч.18'19. Алюмо-аммониевые квасцы служат сырьем в производстве камней синтетического корунда.
Основной сульфат алюминия может быть использован для обогащения бедных сернистых газов (см. гл. XIV) 20.
Предложено использование сульфата алюминия и квасцов в качестве фунгицидов для зеленых растений в виде 0,5—2%-ного раствора при рН 3,5—421.
В США ежегодно производят около 1 млн. т сульфата алюминия 22.
По химическому составу сульфат алюминия и квасцы должны удовлетворять требованиям, приведенным в табл. 43.
|
Очищенный (гост 5.740-71) |
Очищенный (гост 12966 - 67) |
Неочищенный (гост 5155-49) |
Вые технические (ГОСТ 1502^—69) |
|||||
|
I сорт |
11 еорт |
III сорт |
Высший сорт |
I сорт |
II сорт |
|||
|
А1203, не менее. . |
16,3 |
15,0 |
14,5 |
13,5 |
9 |
10,60 |
10,50 |
10,30 |
|
H2S04(cbo6.), ие бо |
||||||||
|
Лее........................... |
Отсут |
0,05 |
0,10 |
0,10 |
2 |
|||
|
Ствие |
||||||||
|
Железо (Fe203), ие |
||||||||
|
Более........................ |
0,02 |
0,04 |
0,10 ~ |
1,5 |
0,8 |
0,0015 |
0,002 |
0,035- |
|
As203, не более. . |
0,001 |
0,003 |
0,003 |
0,003 |
0,003 |
|||
|
Нерастворимый оста |
||||||||
|
Ток, не более. . . |
0,3 |
0,5 |
0,7 |
1,0 |
23 |
0,03 |
0,035 |
0,1 |
|
ТАБЛИЦА 43: Требования к химическому составу технических сернокислого алюминия И квасцов (содержание компонентов в %) |
|
Технический сернокислый алюминий |
|
Квасцы алюмокалне - |
Технический сернокислый алюминий очищенный, получаемый из гидроокиси алюминия или из обогащенного каолина имеет вид Плотных кусков мелкокристаллического строения белого цвета с зеленоватым оттенком, сообщаемым примесью солей • закиснот железа (FeS04). При длительном хранении на воздухе куски сульфата алюминия окрашиваются с поверхности в желтоватый цвет из-за окисления примеси закисного железа в окисное.
Неочищенный сернокислый алюминий, получаемый обработкой серной кислотой каолина с последующей добавкой нефелинового концентрата (ГОСТ 5155—49), содержит кроме сульфата алюминия также квасцы, примеси других сульфатов и нерастворимых веществ. По внешнему виду — это плотные куски кристаллического строения неопределенной формы, серого цвета.
Иногда под названием коагулянтов выпускают и другие продукты, содержащие в качестве основного вещества, помимо сульфата алюминия, и сульфат трехвалентного железа, обладающий таким же коагулирующим действием, как и сульфат алюминия. Поэтому для производства коагулянтов можно применять глины и другие виды сырья, содержащие соединения железа, в частности, колчеданный огарок.
Коагулянты и нечищенный сернокислый алюминий более дешевые, но худшие продукты, чем очищенный сернокислый алюминий, так как содержат много нерастворимых примесей и меньше AI2O3. Удаление примесей из водоочистительной аппаратуры требует дополнительных затрат. Недостатком сернокислого алюминия является его способность слеживаться при хранении. Наряду с твердым сульфатом алюминия используют «жидкий коагулянт» — раствор сульфата алюминия, содержащий 8,3% А120з. Такой раствор дешев, он устойчив при низких температурах (кристаллизация начинается ниже —20°), его легко применять23.
Взамен сульфата алюминия в качестве коагулянта предложено употреблять оксихлориды алюминия, в частности пентаоксихлорид А12(ОН)5С1. В воде он диссоциирует на A12(OH)j и СГ. Его получают действием NaOH на А1С13 или обработкой А1(ОН)3 слабой соляной кислотой. После упаривания раствора и сушки продукт содержит 80% А12(ОН)5С1, т. е. более 40% А1203, что намного больше, чем в сернокислом алюминии 23-27.
СЫРЬЕ
Сырьем для производства сернокислого алюминия28'29 во многих странах служит наиболее дешевый и доступный вид природного материала — глина. Разложение глины производят серной кислотой, которая растворяет содержащуюся в глине окись алюминия по реакции:
А120З + 3H2S04 = A12(S04)3 + зн2о
В СССР сернокислый алюминий получают из каолина, а также растворением в серной кислоте гидроокиси алюминия, вырабаты - чаемой в больших количествах на заводах цветной металлургии. ■Сернокислый алюминий или содержащие его коагулянты получают И из других глиноземистых материалов — нефелина (стр. 639), уртита, кианита (А1203 • Si02), а также из высококремнистых бокситов и золы от сжигания углей.