Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
СОЛИ МЫШЬЯКА
Из солей мышьяка имеют наибольшее значение и изготовляются в больших количествах соли мышьяковистой и мышьяковой кислот 1 — арсениты и арсенаты — главным образом кальциевые и натриевые. На основе этих солей производят также разнообразные препараты, предназначенные для сельского хозяйства.
Исходным материалом для производства солей мышьяка служит мышьяковистый ангидрид, называемый белым мышьяком, получаемый путем окислительного обжига мышьяковых руд 2.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
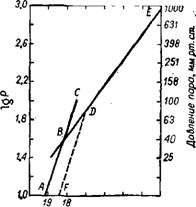
Мышьяковистый ангидрид, или трехокись мышьяка, As203 существует в трех модификациях — аморфной, кубической (октаэдри - ческой) и моноклинной. Точка превращения кубической и моноклинной модификаций (арсенолит=р±клаудетит) при давлении 1 ат равна 3 240±30°. На рис. 427 показано изменение давления пара As203 в зависимости от температуры. Ниже 315° давление пара не является однозначной функцией температуры в связи с превращением октаэдрической модификации АэгОз в моноклинную и образованием твердых растворов. Аморфно-стекловидная модификация (плотность 3,74 г]смг) образуется при медленном охлаждении паров As203 при 200°. Предполагают, что она является смесью обеих кристаллических форм. Аморфная трехокись мышьяка на воздухе постепенно становится фарфоровидной (непрозрачной) и переходит в октаэдрическую форму (плотность 3,64 гсмг). Последняя образуется также при быстром охлаждении возгоняющегося As203. При медленном нагревании до 200° аморфная форма переходит в моноклинную (плотность 4,0 г/см3). Она образуется также при конденсации паров AS2O3 в интервале температур 275—315• Октаэдрические кристаллы плавятся при 275°; моноклинные — при -
Близительно при 315°; аморфно-стекловидная модификация устойчива выше -310°. Ниже 800° трехокись мышьяка существует в Виде димера As406, выше 1700° — только в виде As202.
Мышьяковистый ангидрид плохо растворим в воде: растворимость при 0° равна 1,2 г, при 100° — 6 г в 100 г воды. Водные растворы его имеют кислую реакцию, сладковаты, с металлическим привкусом. Как амфотерный окисел AS2O3 реагирует и со щелочами и с кислотами. Однако кислотные свойства As203 превалируют над щелочными.
Образующаяся при растворении AS2O3 в воде и выделяемая из соединений мышьяковистая кислота НзАэОз стабильна лишь в водных растворах, в которых она диссоциирует по схеме:
As3+ + ЗОН" As(OH)3 =
= H3As03 Н++ AsOJ + Н20
Константы диссоциации H3ASO3 при 20°: /Ci = 4 • Ю-10, К.2 = 7-10-13, К3 = Первая константа дис
Социации As(OH)3 равна 5-10~16.
Растворы мышьяковистого ангидрида легко восстанавливаются 4 до элементарного мышьяка или до арсина AsH3 (/кип = —62,5°). Давление пара AsH3 (в см рт. ст.) может быть определено по Уравнению5: lg Р = —1403,327'-' — 9,43935 lg Т + + 0,0080377 + 28,82835.
|
Температура,°С 315 352 334 441 436 |
|
17 1В 15 1/Т-10* |
|
Рис. 427. Давление пара As203: |
|
ЛВС—давление пара над октаэдриче» скими кристаллами (lg Р = -6670г~' + + 13,728); BDE — давление пара над жидким As203 (lg Р = -2722Г-1 +6,513); FD — давление над моноклинными кристаллами (.Р-в ММ. рт. СТ.). |
Мышьяковистая кислота легко окисляется в мышьяковую азотной кислотой, галогенами и другими окислителями, но устойчива по отношению к газообразному кислороду. Ее соли значительно легче окисляются свободным кислородом, особенно в щелочной среде и в присутствии катализаторов — солей меди, марганца, иода6 и др. Раствор арсенита натрия с молярным отношением As203 : NaOH, равным 1:6, с концентрацией As203 ~ 14—17 г/л, Содержащей 5 г/л солей меди, при барботаже через него воздуха (5—Юл/ч через 100 мл раствора), при 60° окисляется кислородом воздуха в течение 60 мин на 40—45%. Степень окисления 7 возрастает с повышением температуры до 70-—75°, с увеличением Молярного соотношения AS2O3 : NaOH и уменьшается с понижением концентрации АэгОз. Реакция окисления AS2O3 хромовокислым калием при 30°, рН = 8,3—10,6 и ионной силе раствора 1,75
имеет первый порядок относительно концентраций каждого из обоих реагентов8. При рН>9 скорость реакции не зависит от концентрации Н+, а при рН<9 увеличивается с ростом концентрации Н+ При рН = 9,1 константа скорости реакции /С= 1,61 -10_3 л/(г-мол. •сек).
С некоторыми галогенидами (КС1, KBr, KI) мышьяковистая кислота образует в водных растворах комплексные соли переменного состава (MX-reAs203, где X — галоген), разлагающиеся при кипячении. С NaCl и NH4C1 подобные комплексы не образуются 9.
Сложное комплексное соединение 3Cu(As02)2 • Cu(CH3COO)2 называется парижской зеленью; оно не растворяется в воде, но гидролизуется, выделяя свободную мышьяковистую кислоту 10. При односуточном стоянии суспензии из 0,25 г парижской зелени и 100 мл Воды в раствор переходит ~ 0,005 г As203, т. е. около 3—4% общего количества мышьяка. Плотность технической парижской зелени колеблется от 2,8 до 1,3 г/см3, а насыпная масса от — 0,3 г/см3 у очень дисперсных образцов до 1 г/смъ у образцов грубого помола.
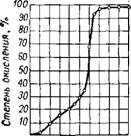
Окисление трехокиси мышьяка в пятиокись AS2O5 (мышьяковый ангидрид) можно производить нагреванием на воздухе до 600—700° (рис. 428). Обрабатывая As203 50—60%-ной азотной кислотой и затем выпаривая из реакционной массы воду, не допуская перегрева выше 350°, можно получить продукт, содержащий 99,5 % и более as2o5. Разложение As205 с отщеплением 02 начинается выше 400° п.
Мышьяковая (ортомышьяковая) кислота H3As04 представляет собой кристаллы ромбической системы, легко растворимые в воде. Из водного раствора выделяется в гидратированной форме 2H3As04-H20 или As205-4H20. При нагревании до 100° частично обезвоживается, превращаясь в 3As205-5H20, а выше 120° разлагается на As2Os и Н20. Полное разложение происходит при ~500° без образования в качестве промежуточных продуктов пиро - и ме - тамышьяковой кислот.
По своим кислотным свойствам мышьяковая кислота подобна фосфорной. Константы диссоциации H3As04 при 20°: /Cj = 6- Х2 = 2-10"7, /С3 = 3-10"12.
|
0 100 300 500 700 300 Температура, °С Рис. 428. Зависимость степени окисления As203 В As205 от температуры (на воздухе в течение 1 ч). |
В системе As205—Na20—Н20 при 20° образуются различные соединения 12. Кислота 4As205-5H20 существует только в растворе, содержащем 70,5% As205. В равновесии с раствором, содержащим 64—70,5% As205 (и 3% Na20), существует 3As205-Na20-6H20, склонный к гидролизу. При дальнейшем понижении концентрации
Д520б от 64 до 61% (при 3—8% Na20) устойчивым является 2As205-Na20-5H20, также склонный к гидролизу. В области концентраций 41—61% As205 (8—14,5% Na20) образуется моноорто - арсенат NaH2As04 • 7Н20, отличающийся высокой растворимостью (~200 г в 100 г Н20). Динатрийарсенат Na2HAs04-7H20 находится в равновесии с растворами, содержащими 20—41 % As20s (12,5—15% Na20), и характеризуется меньшей растворимостью (85 г в 100 г Н20), а тринатрийарсенат — в равновесии с растворами 10,4—20% As205 (7,6—12,5% Na20). В области концентраций 0,2—0,9% As205 (7—27% Na20) существует двойная соль —псев - доарсенат Na3AsO4-0,25NaOH-24H2O, кристаллографически идентичная 12-водному тринатрийарсенату. (Псевдоарсенаты — продукты замещения части кристаллизационной воды арсенатов молекулами NaOH). При добавлении Na2HAs04 к раствору NaOH образуются кристаллогидраты арсената: из раствора с 27—34% Na20 выделяется Na3As04 • 8Н20, при 34% Na20—Na3As04-4H20 (предположительно), в присутствии маточного раствора переходящие постепенно в Na3As04-3H20. Из растворов, содержащих больше 40,5% Na20, кристаллизуется Na0H-H20.
Мононатрийарсенат или дигидроарсенат натрия NaH2As04-H20 при нагревании обезвоживается, затем разлагается, подобно фосфату, пс схеме:
90° 135° 230°
NaH2As04 ------ Na2H2As207 ----------- ~> Na3H2As3O10 —-> (NaAs03)^
Конечный продукт разложения — метаарсенат натрия плавится при 615°13.
Взаимодействие арсената натрия с суспензией гидроокиси кальция протекает в несколько стадий |4:
Na3As04 + Са(ОН)2 + 4Н20 = CaNaAs04 • 4Н20 + 2NaOH 2CaNaAs04 • 4Н20 + Са(ОН)2 + 2Н20 = Ca3(As04)2. ЮН20 + 2NaOH Ca3(As04)2 • ЮН20 + Са(ОН)2 = Ca3(As04)2 • Са(ОН)2 • 4Н20 + 5Н20
В системе СаО—AS2O5—Н20 при 17° устойчивыми являются слеДующие соединения:
|
» » от 2 » 6 > » » 4,6 » 6,8 » » » 6,8 » 7,8 » » » 7,8 » 9,6 |
|
Более 9,6 |
При рН до 2................................... CaH4(As04)2
Ca2H2(As04)2 • 2Н20 Ca2H,(As04)2 • 4Н20 5СаО ■ 2As,05 • ЮН20 Ca3(As04),-JcH20 4СаО • AS205 • 5Н20
4СаО-As205-5H20 обезвоживается при нагревании до 200— 215°, а при 350° превращается в твердый раствор Са(ОН)2 в ди - гидрате трикальцийарсенага ЗСаО-As205-2H20, стойкий вплоть
До 500°.
Промышленные образцы арсената кальция, которым обычно приписывают формулу тетракальцийарсената 4СаО'As205-5H20
20 М. Е. Позин
или Ca3(As04)2-Ca(0H)2-4H20 меняют составив зависимости от производственного режима получения: молярное отношение СаО; : As203 колеблется обычно в пределах 3,3—3,9.
При взаимодействии раствора гидроокиси кальция (не суспензии) с ортомышьяковой кислотой выделяются прямоугольные призмы 4СаО - As205-5H20 и ромбические пластинки ЗСаО-As205-ЮН20. Последний метастабилен в присутствии избытка Са(ОН)2. Устойчивой фазой при 40—60° являются твердые растворы Са(ОН)2 в дигидрате трикальцийарсената ЗСаО. • As20s-2H20.
Водная суспензия 4СаО - •As20s-5H20 имеет значение рН = 9,6, а суспензия ЗС^О • As205 • 10Н2О — 9,1. Эти соединения хорошо растворяются (и потому обладают высокой токсичностью) при рН = 7,5—10. Водные суспензии ЗСаО • As205 • 2Н20 И твердых растворов Са(ОН)2 в этой соли имеют значения рН = 8,3—8,6 и относительно мало растворимы (и менее токсичны)15.
По другим данным 16'17, при 35° в системе СаО— —As205—Н20 стабилен Ca3(As04)2; при СаО: : As205 > 3 осадок состоит из Ca3(As04)2 И Са(ОН)2. При 62° установлено существование Ca3(As04)2-2H20 и 4СаО-As205-xH20, а в области 4>СаО: : As206>3 — твердых растворов Са(ОН)2 в дигидрате трикальцийарсената. При 90° стабильны Ca3(As04)2 и 3Ca3(As04)2-Ca(0H)2.
Арсенат кальция в водной суспензии гидролизуется: CaHAs04 + 2H20 Са(ОН)2 + H3As04
|
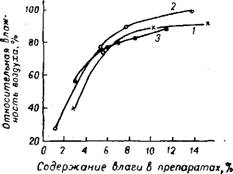
Рис. 429. Зависимость влажности арсеиата кальция от относительной влажности воздуха: |
|
1 — заводской продукт, содержащий 37,760/0 А52О5, 1,20/о водорастворимых AS2O5 + AS2O3, со средним размером частиц 14 мк', 2 — лабораторный препарат, изготовленный нз чистых веществ и содержащий 47,14°/о AS2O5, 0,180/о водорастворимых AS2O5 + AS2O3, со средним размером частиц 18,4 мк', 3 — лабораторный препарат, изготовленный из технических веществ и содержащий 45,660/0 AS2O5, 0,86% водорастворимых AS2O5 + AS2O3 со средним размером частиц 6,8 мк. |
Избыток Са(ОН)2 предотвращает переход мышьяка в раствор. Однако при длительном хранении или нахождении препарата на воздухе содержащаяся в воздухе двуокись углерода карбонизует известь, вследствие чего гидролиз интенсифицируется и появляется свободная мышьяковая кислота. В отличие от лежалого продукта свежий арсенат кальция, состоящий главным образом из основной соли, выделяет водорастворимый мышьяк медленно и в небольших количествах, чем объясняется его безопасность для растений.
Склонность препарата к гидролизу, а также к слеживанию в значительной степени обусловливается гигроскопичностью арсената кальция. На рис. 429 показано изменение содержания влаги в препаратах арсената кальция в зависимости от относительной влажности воздуха. Даже в районах с сухим климатом находящийся на воздухе продукт поглощает больше влаги, чем допускает-» ся ГОСТом (1% —см. стр. 1404). Поэтому его необходимо хранить во влагонепроницаемой таре. Гигроскопичность арсената кальция увеличивается при содержании в нем примесей NaOH или NaCl (даже в количествах всего 0,5%). Однако распыляемость продукта мало зависит от его влажности, если она не превышает 5% 18.
При смешении растворов динатрийарсената и сульфата магния, кобальта, никеля, цинка, меди получаются медленно кристаллизующиеся арсенаты этих металлов 19~22.
Из арсенатов Fe, Си, Zn и Cd при одном и том же значении рН наименее растворим арсенат железа. Растворимость гидроокисей этих металлов больше растворимостей их арсенатов; этим можно воспользоваться для выделения мышьяка из растворов при помощи соответствующих гидроокисей. Из растворов, содержащих, наряду с мышьяком, сульфаты цинка, кадмия и другие, можно селективно выделить мышьяк, осаждая его при низких рН в форме арсената железа 23. Ниже приведены произведения растворимости некоторых арсенатов при 20°24:
|
|
|
|
|
CrAs04 FeAs04 BiAs04 Hg3As04 |
|
Mn3(As04)2 Pb3(As04)2 Co3(As04)2 Ni3(As04)2 A1As04 . . |
При 20° произведения растворимости арсенитов2S: цинка — 2,8- Ю-20, кобальта — 2,2-10"4 серебра — 1,1 • Ю"17.
О растворимости в системах Na3As04—Na2S04—НгО и Cu3 ( As04) 2—CuS04—H20 см.26.
При нагревании арсенатов большинство из них (трех - и четы - Рехзамещенные соли щелочноземельных металлов и ртути состав* ляют исключение) в пределах 500—1000° разлагаются с образованием окисла или металла.
При взаимодействии As203 или сульфидов мышьяка с галогено - водородами образуются галогениды мышьяка. Так, AsCl3 получается при пропускании сухого НС1 над нагретым до 180—200° As203:
As203 +6HC1 = 2AsCl3 + 3H20
Треххлористый мышьяк (/пл = —18°, /Кип=130°) является растворителем для FeCl3, SbCl3 и других соединений и может реагировать и как кислота (AsCl3 + СГ = AsCll) и как основание
(АзС1З = AsClJ + СГ)27. Фтористый мышьяк можно получить по реакции
5As203 + 12HS03F = 4AsF3 + 6H2S04 + 3As20(S04)2
Идущей с сильным экзотермическим эффектом 28. Сплавлением при 800° смеси KAs03 и KF можно получить монофторарсенат калия K2ASO3F. Монофторарсенаты Na, Ni, Со, Zn, Си, Cd и других металлов получаются обменным разложением их перхлоратов с K2ASO3F. По растворимости и формам кристаллогидратов монофторарсенаты имеют сходство с сульфатами 29>30 с которыми образуют или двойные соли, например Zn'(S04, As03F)-7Н20, (NH4)2Ni(S04, As03F)-6H20, или смешанные кристаллы, например монофторарсенат и сульфат калия.