Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
СОЕДИНЕНИЯ ЖЕЛЕЗА
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Сульфат закиси железа, ферросульфат, FeS04 в пределах от — 1,82 до 90° кристаллизуется из водных растворов в форме FeS04-7H20, FeS04 • 4Н20 и FeS04-H20 (рис. 193) Семиводный сульфат закиси железа, называемый в технике железным (зеленым) купоросом, кристаллизуется в интервале от —1,82 до 56,8°
В форме моноклинных кристаллов голубовато-зеленого цвета с плотностью 1,899 г/см3 (15°). На воздухе выветривается, окрашиваясь в желтый цвет, вследствие образования с поверхности Fe(0H)S04. Че - тырехводный кристаллогидрат с плотностью 2,2 г/см3, окрашенный в зеленый цвет, стабилен от 56,8 до 64,0°; при других температурах он может выделяться в метастабиль - ном состоянии. Выше 64° кристал - Рис. 193. Политерма растворимости лизуется FeS04-H20 белого цвета, В системе FeS04-H20. При нагревании FeS04 • 7Н20 он те
Ряет шесть молекул воды. Обезвоживание FeS04-H^0 сопровождается разложением с выделением S02 и образованием основного сульфата железа; прокаливание же на воздухе сопровождается окислением Fe(II) в Fe(III) с образованием Fe20(S04)22. Концентрация насыщенных водных растворов: в криогидратной точке (—1,821°) — 14,91%, при 20° —21,01%, при 56,7° —35,06%, при 64° — 35,57%, при 90,1° —27,15% FeS04. Давление диссоциации одноводного сульфата закиси железа FeS04 ■ Н20 FeS04 + Н20 составляет 0,4 мм рт. ст. при 50°, 0,8 мм рт. ст. при 70°, 3,8 мм рт. ст. при 90°. В обычных условиях
FeS04-H20 полностью обезвоживается при 300°, частично разлагаясь при этом.
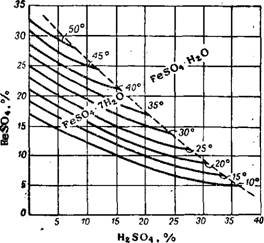
Растворимость сульфата закиси железа уменьшается в присутствии свободной серной кислоты, которая высаливает кристаллогидраты FeS04 из растворов (рис. 194) Уменьшается также и предельная концентрация раствора, соответствующая точке перехода FeS04 • 7Н20 в FeS04 • Н20. В системе FeS04— H2S04—Н20 при 50°" существуют области кристаллизации стабильных FeS04 • 7Н20„
|
Рис. 194. Растворимость FeS04 • 7Н2О в зависимости от содержания в растворе свободной H2SO« При различных температурах. |
FeS04-4H20, FeS04-H20 и FeS04 и метастабильных FeS04-7H20 и FeS04-4H20. При концентрациях H2S04, лежащих за стабильной областью существования гепта - и тетрагидрата, ив пересыщенных растворов в первую очередь выделяется метаста - бильный гептагидрат, который затем превращается в метастабиль - ный тетрагидрат с большей скоростью, чем последний переходит в стабильный моногидрат. При 60° гептагидрат не образуется, а при 70 и 90° не выделяется также и тетрагидрат.
В интервале 50—90° при концентрации H2S04 меньше 27,2% температурный коэффициент растворимости FeS04 • Н20 отрицателен, а при более высокой концентрации серной кислоты — положителен (в пределах 50—70° температурный коэффициент снова становится отрицательным при концентрациях выше 76% H2S04). При высоких температурах растворимость FeS04 в серной кислоте Резко уменьшается. Так, при 200—240° в растворе, содержащем ~91% HjS04, находится всего 0,2—0,3% FeS04. При этом FeS04 частично переходит в Fe2(S04)3 в результате реакции:
2FeS04 + 2H2S04 = Fe2(S04)3 + S02 + 2H20
Растворимость Fe2(S04)3 в концентрированной серной кислоте до 200" немногим превышает 0,1% 3.
Сульфат окиси железа, феррисульфат, Fe2(S04)3 кристаллизуется из водных растворов в форме 12, 10, 9, 7, 6 и 3-водных кристаллогидратов. Десятиводный кристаллогидрат и безводная соль встречаются в природе в виде минералов квенстетита и коквим - сбита. Желтые кристаллы девятиводной соли Fe2(S04)3 • 9Н20 имеют плотность 2,1 г/см3. Ромбические кристаллы безводной соли имеют плотность 3,1 г/см3 (18°). При 20° в 100 г воды может раствориться 440 г Fe2(S04)3 • 9Н20. В водных растворах сульфат окиси железа сильно гидролизуется, особенно при повышенных температурах. Он очень гигроскопичен, на воздухе расплывается. С сульфатами щелочных металлов и аммония он образует двойные соли M[Fe(S04)2] • 12Н20, из которых наиболее распространены железные квасцы NH4[Fe(S04)2] • 12Н20.
Давление диссоциации сульфата окиси железа по реакции Fe2(S04b^Fe203 + 3S03 равно при 614° 70 мм рт. ст., при 650° 149 мм рт. ст.
Давление диссоциации сульфата закиси железа по реакции 2FeS04 Fe203 + S02 + S03 равно при 614° 254 мм рт. ст., при 650° 600 мм рт. ст.
В отсутствие кислорода FeS04 разлагается с достаточно большой интенсивностью и полнотой при 700°. В токе воздуха его разложение значительно ускоряется в присутствии восстановителей — угля и пирита. При взаимодействии FeS04 с FeS или FeS2 (700— 800°) образуются Fe304 и S024. Смесь из 82,3% FeS04-H20, 15,2% FeS2 и 2,5% угля разлагается в токе воздуха при 600° за 40— 60 мин на 98%. С увеличением содержания кислорода в газовой фазе скорость разложения FeS04 уменьшается в отсутствие восстановителей (колчедана, угля), но возрастает в их присутствии. Это объясняется тем, что восстановители, сдвигая реакцию S03 S02 + Vо02 вправо, ускоряют тем самым диссоциацию FeS045~10. О термическом разложении сульфата закиси железа во взвешенном слое см.11.
Сульфат окиси железа в присутствии углерода восстанавливается до сульфата закиси железа
Fe2(S04)3 + С = 2FeS04 + С02 + S02
А сульфат закиси железа при не очень высоких температура: только частично разлагается до закиси железа:
2FeS04 + С = 2FeO + С02 + 2S02
Степень превращения Fe2(S04)3 в FeS04 возрастает с увеличением температуры, длительности взаимодействия и поверхности частип угля. При 300° и диаметре частиц угля меньше 3 мм степень превращения за 60 мин составляет 53%, за 90 мин — 76%, за 120 мин — 90% 12.
На отличии свойств сульфатов железа (давление диссоциации, растворимость) от сульфатов других металлов основано обогащение руд и концентратов в цветной металлургии еульфатиза - цией 13-14. Материал, гранулированный с серной кислотой, подвергают сульфатизирующему обжигу во взвешенном слое. При этом железо переходит в нерастворимые соединения, и при последующем выщелачивании получают растворы, в которых отношение Fe к Со, Си, Zn и другим ценным металлам в десятки раз меньше, чем в исходных материалах.
В присутствии воздуха или водяного пара FeS04 нонвертируег хлориды щелочных металлов в сульфаты 15.
В присутствии кислорода в водном растворе происходит постепенное окисление FeSC>4. В присутствии серной кислоты и с повышением ее концентрации скорость окисления ферроеульфата в феррисульфат значительно уменьшается 16. Окисление FeS04 ускоряется при пропускании через раствор газа, содержащего SOj и 02При этом происходит образование Fe2(S04)3:
2FeS04 + 02 + S02 = Fe2(S04)3
В свою очередь, Fe2(S04)3 восстанавливается двуокисью серы до FeS04 с одновременным образованием свободной еерной кислоты:
Fe2(S04)3 + S02 + 2Н20 = 2FeS04 + 2H2S04
Образующийся по последней реакции Fe2+ вновь окисляется в Fe3+. В зависимости от условий взаимодействие FeS04 с S02 может быть направлено в сторону образования Fe2(S'04)3 или H2S04. На этом основан каталитический метод окисления S02 в водном рйстворе в присутствии ионов железа. При 80°, концентрации S02 в газе 3% (а также и при меньших концентрациях), отношении S02: 02, равном 1 :4, и содержании Fe2+ в растворе 30 г/л можно получать растворы, содержащие 20—25% H2S0413'19.
В гидрометаллургии цинка окисление Fe2+ производят при его концентрации в растворе всего ~2 г/л Fe2+ (в виде FeS04) и при рН « 5—5,2 в присутствии твердой фазы из продуктов гидролиза, окисленных соединений железа. В этом случае значительную роль в процессе окисления Fe2+ играет адсорбция кислорода осадками окисиых соединений железа20.
Запатентованы методы бактериального окисления солей двухвалентного железа в кислых растворах21.
В водных растворах ион Fe3+ Может гидролизоваться' по следующим схемам22:
Fe3+ + Н20 Fe(OH)2+ + Н+
Fe3+ + 2H20 Fe(OH)J + 2Н+
2Fe3+ + 2Н20 Fe2(OH)2+ + 2Н+
В' соответствии с этим из растворов солей трехвалентного железа выделяются разные основные соли 23'24.
Железо-аммонийные квасцы NH4Fe(S04)2- 12Н20 — фиолетовые кристаллы октаэдрической формы с плотностью 1,71 г/см3. Плавятся при 40°. Растворимость в 100 г воды равна при 25° 124 г, При 100° 400 г.
Хлористое железо FeCi2 образуется в виде зеленовато-серых гексагональных кристаллов с плотностью 2,98 г/см3-, на воздухе они желтеют вследствие окисления. Плавится при 672°, кипит при 1026° (760 мм рт. ст.). Давление пара при 700° 10 мм рт. ст., при 842° 100 мм рт. ст. В паре при температуре кипения находятся FeCi2 и Fe2CI4, а выше 1500° только FeCi2. Образует кристаллогидраты с 1,2, 4 и 6 молекулами воды. Температура превращения FeCl2-2H20 в FeCl2-4H20 (голубовато-зеленые моноклинные кристаллы с плотностью 1,93 г/см3) 76,5°, температура превращения FeCl2-4H20 в FeCl2-6H20 равна 12,3°. В насыщенном водном растворе при 20° содержится 40,5%, при 117,5° (TKnn) 50,3% FeCI2. Водные растворы FeCl2 слабо гидролизованы. С хлоридами щелочных металлов FeCi2 образует три типа комплексов: M[FeCI3], M2[FeCi4] и M4[FeCl6], например, KFeCl3 • 2Н20, K3Na{FeCl6].
Хлорное железо FeCI3— сильно гигроскопичные коричневато - черные кристаллы гексагональной формы с плотностью 2,8 г/см3. Плавится при 309°, кипит при 319° (760 мм рт. ст.). Давление пара при 194° 1 мм рт. ст., при 235,5° 10 мм рт. ст., при 272,5° 100 мм рт. ст., при 298° 400 мм рт. ст. Пары при 400° состоят из Fe2Cl6, при 750° — из FeCl3. Выше 500° под разрежением FeCi3 разлагается на FeCl2 и хлор. Хлорное железо образует ряд сильно гигроскопических кристаллогидратов, расплывающихся на воздухе, из которых конгруэнтно плавятся коричнево-желтые кристаллы FeCl3 • 6Н20 при 37°, FeCl3 • 3,5Н20 при 32,5°, FeCl3 • 2,5Н20 при 56°, FeCl3 -2Н20 при 73,5°. Ниже 0 ± 2е существует плавящийся инконгруэнтпо FeCl3 • ЮН2025. Криогидратная точка водного раствора —5,5°. Насыщенный водный раствор содержит при 20° 47,9% FeCI3.
В разбавленных растворах FeCi3 гидролизуется до Fe(OH)2+ (константа гидролиза при 20° равна 24,8 -10~4), а в очень разбавленных (Ю-3—Ю-4 М) до Fe(OH)2 ' , Из разбавленных и концентрированных растворов выделяются основные соли — оксихлориды, Яапример 7Fe203• FeCI3• 21Н20, 8Fe203-FeCI3- 16Н2028. Хлорное железо образует комплексы типа [FeCl4]~ и [FeCl6]2~. В солянокислых растворах, насыщенных хлоридом щелочного металла, ион
_29
Fe3+ находится только в виде FeCl3 и FeCU.
Окислы железа в воде не растворимы. Закись железа FeO (вюс - тит) имеет черный цвет и плотность 5,7 г/см3. Закись-окись железа Fe304 (магнетит) также черного цвета, плотность 5,2 г/см3. Окись железа Fe203 (гематит) красного цвета, плотность 5,24 г/см3. Температура диссоциации FeO (р0 = 0,21 ат) равна 2500°. Давление 0« над FeO при 750° равно 1,602-10"17 мм рт. ст., а при 950° — 1,49 • Ю-11 мм рт. ст.
Окись железа диссоциирует при не очень высоких температурах П350—1500°) с образованием твердых растворов Fe203—Fe304 и Fe304. Давление 02 над Fe203 при 427° равно 2,241 ■ Ю-26 мм рт. ст. Закись и закись-окись железа при нагревании (в присутствии воздуха) переходят в окись железа. Давление 02 над Fe304 при 725° равно 4,25- Ю-17 мм рт. ст.
Гидрат закиси железа Fe(OH)2 имеет зеленоватый цвет и плотность 3,4 г/см3. Растворимость при 18° 0.00015 г в 100 г воды. Растворяется в кислотах и в растворе NH4C1. При 150—900° полагается3?'31:
4Fe(OH)2 = Fe + Fe304 + 4Н2.0
Гидрат окиси железа Fe(OH)3 красно-коричневого цвета, плотность 3,4—3,9 г/см*. При нагревании до 500° отщепляет 1,5 Н20. Растворимость при 18° 0,000048 г в 100 г воды.
ПРИМЕНЕНИЕ
Железный купорос, являющийся контактным ядом, используют в сельском хозяйстве для борьбы с вредителями садов и слизнями. Его применяют также для уничтожения мхов, лишайников и грибных спор, которые он убивает уже при концентрации 0,14%. По своим фунгицидным свойствам железный купорос в 10 раз слабее медного купороса32'33. Железный купорос используют и для питания растений. Железо необходимо растениям как катализатор для образования хлорофилла. При недостатке железа растения заболевают хлорозом, и листья теряют зеленую окраску. Помимо этого, железо входит в состав многих окислительных ферментов и играет большую роль в дыхании растений.
Железный купорос применяют в текстильной промышленности, Для изготовления чернил, в фотографии и др. Наряду с окислами железа его используют для приготовления минеральных красок.
Отбросные растворы сульфатов железа можно переработать в Изоляционный материал — феррон или ферри-гипс, представляющий собой смесь гидратов окислов железя и гипса с наполнителем Этот материал пригоден для тепловой изоляции химической аппаратуры, из него могут быть изготовлены и строительные плиты 3<. В США значительные количества сульфата окиси железа применяют для травления металла; выпускаемый для этой цели препарат «Феррисул» содержит 90% Fe2(S04h и примеси — 0,5— 2% FeS04, 3% Fe203 (нерастворимой), 2% Si02, 1,5% A12(S04)3, ~3% свободной H2S04, 0,5% CaS04 и др.35.
Сульфат окиси железа, а также хлорное железо используют в качестве коагулянтов при очистке воды. Хлорное железо является хорошим коагулянтом в щелочной среде. За рубежом его применяют также для очистки вод, содержащих серу, сульфиты и сульфиды, и как добавку при сушке осадков, отделяемых фильтрацией при очистке канализационных вод. Применяемое для этой цели хлорное железо выпускают под названием «перхлорид железа» в баллонах в виде 41% раствора и разбавляют перед использованием36. Для очистки сточных аммиачных вод на небольших газовых заводах рекомендуют применять железный купорос37. Его же, так же как и хлорное железо, можно использовать для очистки промышленных газов от сероводорода с получением при этом элементарной серы38. Сульфат окиси железа может применяться в качестве протравы при крашении шерсти и в качестве среды для обогащения многосернистых углей. Кислые растворы сульфата окиси железа используют как окислительную среду при извлечении полезных компонентов из руд39.
Окислы и гидраты окислов железа служат пигментами. Гидроокись железа обладает сорбционными свойствами, которые используются в гидрометаллургии при очистке растворов от примесей некоторых катионов. Ферромагнитные окислы железа — магнетит, у-окись железа, а также ферриты применяют в электротехнике, в Частности в производстве магнитных звуковых лент*0.
Технический железный купорос, согласно ГОСТ 6981—54, должен содержать (в %):
Марка А Марка Б
TOC o "1-3" h z FeS04, Не менее.......................... 53,0 47,0
Свободной серной кислоты,
Не более....................................... 0,25 1,0
Нерастворимого остатка, не
Более............................................ 0,4 1,0
Продукт упаковывают в деревянные бочки, фанерные барабаны Или деревянные ящики.
Аккумуляторный железный купорос, получаемый перекристаллизацией технического продукта, должен содержать не менее 19,5% железа и не более (в % от Fe): 0,1—Мп, 0,02 — Са, 0,03— Сг, 0,03 —Ti, 0,02 —V, 0,02 — А1, 0,03 —Mg и 0,04 Си; сумма примесей в продукте (без Мп и Си) не должна превышать 0,03%.
Хлорное железо безводное, получаемое хлорированием при высокой температуре, выпускают 1 и 2 сорта. По ГОСТ 11159;—65,
Оии должны содержать соответственно не менее 97 и 95% FeCIa и не более 1 и 2% FeCb; не растворимых в воде примесей в продукте 1 сорта должно быть не более 2%. Тарой для хлорного железа служат стальные барабаны, покрытые внутри лаком этиноль.