Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
Получение нитрофоски с вымораживанием части нитрата кальция
При охлаждении раствора, полученного при разложении фосфатов азотной кислотой, кристаллизуется четырехводный нитрат кальция. При избытке азотной кислоты нитрат кальция выделяется
в виде двойной соли четырехводного кристаллогидрата с азотной кислотой, отвечающей формуле 3Ca(N03)2- 12H20-HN03. Наибольшее влияние на степень осаждения нитрата кальция оказывает концентрация исходной азотной кислоты (рис. 394). Чем она больше, тем больше выделяется нитрата кальция. Следовательно, используя для разложения фосфата азотную кислоту более высокой концентрации, можно выделить из раствора то же количество СаО с меньшей затратой холода 174.
|
5 |
Влияние нормы азотной кислоты на степень осажде -
|
Г |
|||||
|
- |
/ / j |
||||
|
— А) |
|||||
|
S* 6 ео А |
|
- 10 S I 50 4 50 « 40 « £ 30 0> £ 20 |
|
,20 *15 *10 «-5 0 -5 Температура, "с |
|
-10 |
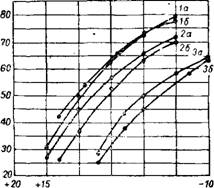
Рис. 394. Степень выделения СаО в виде нитрата кальция в зависимости от концентрации исходной азотной кислоты и температуры охлаждения
Азотиокислотной вытяжки. Концентрация азотной кислоты: / — 55%; 2-52%; 3 — 50%;
4 — 47% HN03.
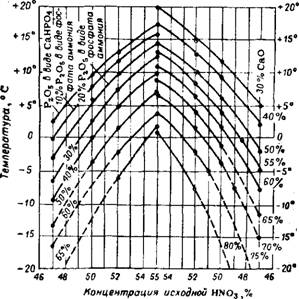
Иия СаО в виде нитрата кальция показано на рис. 395. Увеличение нормы азотной кислоты сверх стехиометрической снижает степень выделения СаО, в основном за счет разбавления раствора. (О выделении СаО и MgO из растворов, полученных при азотнокислотном разложении фосфоритов Каратау, см. 43-75'176). На рис. 396 приводятся данные о степени выделения СаО в виде твердого нитрата кальция Ca(N03)2 • 4Н20 (В % от исходного) в зависимости от концентрации исходной азотной кислоты и температуры охлажденного раствора (справа) и о содержании водорастворимой Р2О5 в продукте в виде фосфата аммония при соответствующем количестве выделенной СаО (слева). На рис. 397 приведено отношение СаО к Р2О5 в растворе, получаемое в зависимости от концентрации исходной кислоты и температуры охлаждения ^s—177_
|
*Ю +5 0 -5 Температура,°С Рис. 395. Влияние нормы азотной кислоты иа степень выделения СаО в виде Ca(N03)2 • 4Н20. Концентрация кислоты: / — 52%; 2 — 50%; 3 — 47% HN03. Норма от стехиометрического количества: а — 1,3, б — 1,5. |
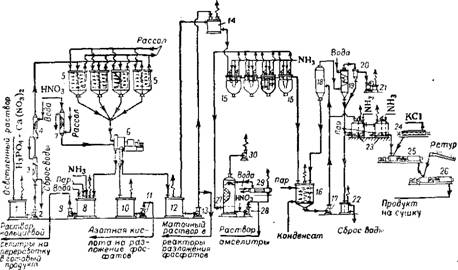
Производство нитрофоски с вымораживанием избытка нитрата кальция осуществляют следующим образом (рис. 398) 178"180. Рас
твор, полученный при разложении фосфатов азотной кислотой и отделенный от нерастворившегося остатка (шлама), поступает в сборник 1, из которого насосом 2 перекачивается в систему кристаллизаторов 5. Предварительно раствор охлаждается водой с 50 до 25—30° в холодильниках 3 и 4. В кристаллизаторах 5 при охлаждении до —5, —10° рассолом, циркулирующим в змеевиках, из раствора вымораживается нитрат кальция. (Предложен метод охлаждения путем непосредственного соприкосновения раствора
|
Рнс. 396. Зависимость степени выделения СаО н содержания водорастворимой Р205 в продукте от концентрации азотной кислоты и температуры раствора. |
С инертным хладагентом — бензином. Процесс осуществляется следующим образом. Бензин, предварительно охлажденный жидким аммиаком, распыляется в растворе в виде мелких капель. Капли, поднимаясь вверх, охлаждают раствор и своим потоком поддерживают во взвешенном состоянии образовавшиеся мелкие кристаллы. По мере роста крупные кристаллы падают на дно кристаллизатора, а бензин собирается в верхней части кристаллизатора, откуда вновь возвращается в цикл 181.)
Очень важно в процессе кристаллизации получить крупные кристаллы нитрата кальция, которые затем более полно могут быть
отделены от раствора. Поэтому охлаждение раствора производят медленно, с постепенным понижением температуры до заданной. Зависимость величины получаемых кристаллов Са (N03)2-4H20 от скорости охлаждения показана в табл. 102. Из приведенных данных видно, что наиболее крупные, хорошо фильтрующие кристаллы Са (N03)2 • 4Н20 получаются при медленном понижении температуры и общем времени кристаллизации 5—6 ч. Это время кристаллизации должно быть выдержано независимо от температуры кристаллизации. При быстром вымораживании образующиеся мелкие кристаллы нитрата кальция при фильтрации проходят в маточный раствор и увеличивают в нем отношение СаО : Р205, что способствует ухудшению качества продукта.
Добавкой к раствору концентрированной фосфорной кислоты, высаливающей Ca(N03)2 • 4Н20, можно Сократить вымораживание до 1 ч, и при этом охлаждать раствор лишь до +3, +9° (в зависимости от количества кислоты)182.
В процессе охлаждения раствора происходит налипание выделившихся кристаллов на охлаждающую поверхность, которую необходимо очищать. После окончания кристаллизации и опорожнения кристаллизаторов, в змеевики вместо рассола подают пар или горя - чую воду для оттаивания поверхности змеевиков от налипших кристаллов.
Смесь маточного раствора с кристаллами направляют для разделения на автоматическую центрифугу 6 непрерывного действия. Кристаллы промывают азотной кислотой, предварительно охлажденной до —10° в холодильнике 7. Промывную кислоту возвращают в реакторы на разложение фосфатов.
Выделенный четырехводный кислый кристаллический нитрат кальция обладает плохими физическими свойствами и содержит около 10—11 % азота. Для получения готового продукта с лучшими физическими свойствами и с более высоким содержанием азота (15,5%) его растворяют в воде, нейтрализуют аммиаком до рН = 9 и направляют на переработку (стр. 1215).
|
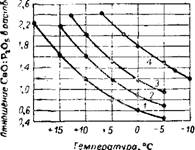
Рис. 397. Отношение СаО: Р205 в растворе в зависимости от концентрации исходной азотной кислоты и температуры охлаждения. Концентрация азотной кислоты: 1 —55%; 2-520/0; З-500/о; 4- 470/0 HN03. |
О новейших усовершенствованиях в переработке Ca(N03)2-4H20 см_ 27,183,184 в частности, разработан способ, в котором смесь Са (N03) 2 и K2S04 конвертируют при 300° в KN03 и CaS04; при добавке карбамида или аммофоса получают удобрения, например,
|
Типа 20—0—20 или 12—24—14 и др. 185. Осуществляют также конверсию расплавленного в собственной кристаллизационной воде нитрата кальция газообразными СОг и NH3; карбонат кальция от -
Рис. 398. Схема производства нитрофоски способом вымораживания: Соорник раствора; 2, 9, 11, 13, 17 и 28 — центробежные насосы; 3 и 4 — водяные холодильники; 5 — кристаллизатор; центрифуга; 7 — рассольный холодильник для HN03; 8 — сборник нитрата кальция; 10 — соорник HNO3; 12 — сборник маточного раствора; 14 — напорный бак; 15— нейтрализатор I ступени; /6—подогреватель; 13 — испаритель; 19 — барометрический конденсатор; 20— ловушка; 21 — вакуум-насос; 22 — барометрический ящик; 23 — нейтрализаторы И ступени; 24 — шнек для KCI; 25 — смесительный шнек; 26— шиек-гранулятор; 27 — скруббер; 29 — холодильник; 30— вентилятор. |
Фильтровывают, а раствор NH4N03 направляют в основной производственный поток 27.
Маточный раствор из сборника 12 подают на нейтрализацию. Часть маточного раствора возвращают в цикл в реакторы разложения фосфатов. Возврат холодного маточного раствора в реакторы
ТАБЛИЦА 102
Зависимость величины кристаллов Са(Ы03)г • 4Н20 от скорости охлаждения (при концентрации исходной азотной кислоты 47—49% HN03)
|
Температура вымораживания, °С |
|
Величина кристаллов, |
|
Примечание |
Общая продолжи' тельность кристаллизации
|
175 X 175 350 X 520 |
|
-7 -10 |
Ч 50 мин
|
875 X 875 |
|
-12 |
» 25 »
5-6 ч
Имеетси большое количество кристаллов 175 X 175 мк Имеется некоторое количество конгломератов
Разложения производят в целях снижения температуры реакционной массы для уменьшения коррозии аппаратов, которая происходит вследствие использования в этом процессе большого избытка азотной кислоты (30—50%) против стехиометрической нор-; мы из расчета на СаО. Кроме того, фосфорная кислота действует! высаливающе на нитрат кальция.
Приводимые ниже данные характеризуют изменение выхода! нитрата, возвращаемого в рабочий цикл: j
Количество возвращаемого раствора (%Р205от | количества Р205 в апатите) О 50 75 100 J
Выход Ca(N03)2, '% ....................................................... 63 67 76 76 1
J
Процесс нейтрализации маточного раствора газообразным ам-1 миаком проводится в две ступени с промежуточным выпариванием! раствора. В первой ступени нейтрализацию ведут до рН = 3,5—3,8,1 а во второй — до рН = 6—6,8. Маточный раствор после выделения из него части Ca(N03)2 в основном содержит Н3РО4, Ca(N03)2 и HN03. При нейтрализации этого раствора аммиаком до рН = = 3,5—3,8 выделяется осадок, состоящий из дикальцийфосфата с примесью небольших количеств трикальцийфосфата. Кроме того, в осадке содержатся небольшие количества фторида кальция, кремневой кислоты, фосфатов алюминия, железа и редкоземельных элементов. В растворе находятся аммиачная селитра и моноаммо- нийфосфат. В процессе выпаривания пульпы в осадок выделяется также часть моноаммонийфосфата 186.
Первую ступень нейтрализации осуществляют непрерывным способом последовательно в нескольких реакторах 15. Для этой цели могут применяться реакторы различной конструкции, обеспечивающие интенсивное перемешивание и хорошее распределение аммиака в жидкой фазе. Процесс нейтрализации протекает с выделением тепла. Температуру поддерживают на уровне 110°. Выпаривание раствора ведут под разрежением 500—600 мм рт. ст. до конечного содержания воды ~14%- Выпариваемый раствор циркулирует между подогревателем 16 и вакуум-испарителем 18. После выпарки раствор направляют в нейтрализаторы второй ступени 23 И затем в смесительный шнек 25, где в пульпу добавляют хлористый калий. _ .
TOC o "1-3" h z При нейтрализации во второй ступени часть моноаммонийфос! фата превращается в диаммонийфосфат. Приблизительное балАн| Совое уравнение нейтрализации: 1
ЗН, РО« + L,5Ca(N03)2 + 0,5HN03 + 4,25NH3 - 3,5NH4N03 + 1
+ 1,5СаНР04 + 0,25NH4H2P04 + 0,25(NH4)2HPQ4 J
При добавке в пульпу KCI и последующей ее тепловой обра| ботке идет обменное разложение: 1
КС1 + N H4N03 = KN03 + NH4C1
Образующиеся нитрат калия и хлорид аммония также являются компонентами получаемой нитрофоски.
Из смесительного шнека пульпа поступает в грануляционный шнек 26, где ее смешивают с ретуром и затем сушат, охлаждают и подвергают рассеву и дроблению для получения продукта необходимого гранулометрического состава с размером гранул 3—4 мм ш. Во избежание налипания материала на стенку сушилки, что сопровождается перегревом и разложением содержащегося в удобрении нитрата аммония, количество влаги в гранулах, направляемых на сушку, не должно превышать 4%. Для этого требуется большое количество ретура, во много раз превышающее количество готового удобрения.
|
Нитрофос |
В табл. 103 и 104 приводится состав готовых продуктов (ни -
ТАБЛИЦА 103
|
Содержание питательных веществ в зависимости от их соотношения и доли Р205 в водорастворимой форме
ТАБЛИЦА 104 Расходные коэффициенты на 1 г сложного удобрения |
Нитрофоска
Апатитовый концентрат, т Фосфориты Каратау, т. . Азотная кислота (100 %), т Аммиак (100%), кг... . Хлористый калий (95%), т
Холод, Мкал............................
Условное топливо, Кг. . .
|
1:1:0 |
Пар, т....................................
Вода,
Электроэнергия,, кет • ч
|
0,41 |
0,48 |
||
|
0,78 |
0,97 |
— |
— |
|
1,12 |
1,23 |
0,73 |
0,62 |
|
148,5 |
144,8 |
113,0 |
95,5 |
|
- |
_ |
■0,27 |
0,30 |
|
250 |
312 |
100 |
155 |
|
30 |
37,5 |
25 |
23 |
|
0,48 |
0,6 |
0,40 |
0,35 |
|
30 |
37,5 |
30 |
28 |
|
63 |
78,5 |
68 |
63 |
|
N : Р205 : К20 |
|
1 ; 1,5 : 0 |
|
: 1 : 1 II : 1,5 : 1,5 |
Отходы
Кальциевая селитра в пересчете на гоТовый продукт [79,5% Ca(N03)2], Т Паровой конденсат, т
|
0,85 |
1,06 |
0,60 |
0,46 |
|
0,34 |
0,48 |
0,32 |
0,28 |
Трофоски и нитрофоса), полученных по способу с вымораживанием и расходные коэффициенты в зависимости от соотношения питательных веществ и содержания водорастворимой формы Р2О5.
Нитрофоска, полученная из апатитового концентрата при весо вом соотношении в ней N : Р205: КгО, равном 1:1:1, содержит 15,3% СаНР04, 13% NH4H2PO4, 16,3% NH4NO3, 30,9% KNOs, 2,5% KCl, 4,5% нерастворимых примесей и 1% воды.