Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
Получение четыреххлористого титана из рутилового концентрата и титанистых шлаков
При использовании в качестве сырья рутилового концентрата или продуктов обезжелезивания ильменитового концентрата прямым восстановлением или восстановительной плавкой хлорированию подвергают материал, содержащий двуокись титана. Непосредственное взаимодействие двуокиси титана с хлором идет по реакции
TiOa + 2С12 = TiCl4 + 02 - 45 ккал
Без образования оксихлоридов титана64, но протекает с небольшой скоростью даже при высоких температурах (800—1000°).
В отсутствие восстановителя хлорирование ильменита практически приводит к образованию FeCl3 и чистой Ti02 65. В присутствии угля хлорирование ТЮ2 наблюдается уже при 400—450°, а при 600—800° протекает со скоростью, достаточной для практического его использования. При этом в зависимости от условий осуществления процесса (главным образом, от температуры) образуется окись углерода или двуокись углерода, или фосген 6б~71: ТЮ2 + 2С12 + 2С = TiCl4 + 2СО + 7,8 ккал Ti02 + 2Cl2 + C = TiCU+G02 + 49 ккал ТЮ2 + 4С12 + 2С = TiCl4 + 2СОС12 + 62 ккал.
Образование низших хлоридов титана (TiCl3 и TiCl2) является термодинамически маловероятным 66.
Ниже 600° хлорирование идет с образованием двуокиси угле-, рода, а выше 600° — преимущественно окиси углерода72. При 900—1000°, помимо окиси углерода, образуется некоторое количество фосгена. В диапазоне 600—800° скорость образования фосгена невелика. При хлорировании выше 1300° газообразные продукты содержат73 практически только окись углерода (2/з объема) и четыреххлористый титан (!/з объема).
Скорость хлорирования зависит от размеров частиц сырья, скорости потока хлора и температуры. В присутствии катализатора (около 0,1% двуокиси марганца) хлорирование ТЮ2 ускоряется особенно при низких температурах. Степень превращения ТЮ2 в ИСЦ в лабораторных условиях при 400° достигает 70% (за 4 ч) Вместо 15% без катализатора. Так как хлорирование ведут обычно в шахтных печах, то сырьевые материалы предварительно брикетируют,
|
Г « б Вес брикета, г |
|
Рис: 445. Зависимость степени хлорирования двуокиси титана От веса брикетов при 700°. |
Скорость хлорирования брикетов из двуокиси титана и 26% нефтяного кокса зависит от величины брикетов 74. На рис. 445 показано изменение степени хлорирования ТЮ2 в зависимости от первоначального веса брикетов при скорости хлора 20 см/мин. Для брикетов цилиндрической формы глубина хлорирования х,
If'
<§1 °30а 400 500 600 700 воо. 5 Температура, X
Рис. 446. Влияние темпера - туры на скорость хлорирования ТЮ2.
Представляющая собой толщину слоя брикета в см, вступившего в реакцию за время т, может быть вычислена по формуле
Где р— плотность брикета, г/см2-, Р0— начальный вес брикета, г; г] — степень хлорирования.
Величина х вычисляется как полуразность определяющих диаметров брикетов LL2(D0 — D) до реакции (D0) и оставшегося (D) к моменту т. Можно принять, что скорость хлорирования пропорциональна внешней поверхности брикета, т. е. -~- = kS (где 5 — переменная величина внешней поверхности без учета пористости); так как Dp = рSdx, то = (где K — удельная скорость хлорирования), и, следовательно, глубина хлорирования прямо пропорциональна времени. С уменьшением размера брикетов
увеличивается общая реакционная поверхность и тем самым ускоРяется процесс хлорирования. Но при очень малых размерах бри - кетов возрастает гидравлическое сопротивление. На рис. 446 показано влияние температуры на скорость хлорирования двуокиси титана при скорости потока хлора 16 см/мин. При 550° процесс при малой линейной скорости хлора переходит из кинетической в диффузионную область. Для кинетической области эффективная энергия активации реакции равна 37,5 ккал/моль. Скорость хлорирования пропорциональна линейной скорости хлора в степени 0,43 (измерено в пределах от'13 до 41 см/мин) И возрастает пропорционально содержанию хлора в газовой фазе при концентрациях выше 30% (рис. 447).
Хлорирование ведут при 800—900°. Подогрев массы до температуры реакции осуществляется частично электрическим током при помощи угольных электродов, частично за счет выделяющегося тепла реакции. Газы, пройдя пылеуловитель, поступают в конденсационную систему, состоящую из скруббера и трубчатых холодильников, где происходит ожижение и отделение Т/С14. Несконденсировавшиеся газы после дополнительной очистки выбрасываются в атмосферу. Жидкий TiCl4 загрязнен твердыми, а также растворенными хлоридами. После фильтрации и дистилляции его очищают от соединений ванадия при помощи медного порошка и от четыреххлористого кремния— ректификацией (стр. 1493).
|
А 5 Ад 4 I*. Eg 2 И О |
|
Содержание хлора 6 газовой срозе, % |
|
Юо |
|
20 ео |
|
Рие. 447. Зависимость Скорости хлорирования ТЮ2 от концентрации Хлора в газовой фазе. |
Примеси, содержащиеся в сырье, особенно при переработке титанистых шлаков из ильменита, увеличивают расход хлора 75 и затрудняют ведение процесса. Наряду с TiCl4 образуются также летучие и нелетучие хлориды и оксихлориды. В табл. 116 приведены температуры плавления и кипения некоторых хлоридов.
|
ТАБЛИЦА Пб Температуры плавления и кипения некоторых хлоридов и оксихлоридов
|
Летучие вещества — FeCl3) SiCl4, ZrCl4, А1С13, V0C13, С0С12, SCb, SnCl4, HC1 — удаляются из печи и конденсируются вместе с TiCl4 частично в твердом, а частично в жидком состоянии.
Часть нелетучих и высококипящих хлоридов — кальция, магния, марганца, алюминия, железа, нехлорированные соединения кремния (в количестве около 50% от общего количества кремния) остаются в печи и выпускаются в расплавленном виде.
Присутствие в шлаке свободного кремнезема затрудняет удаление жидких хлоридов из печи76. Свободный кремнезем медленнее хлорируется и хуже удаляется из печи, чем связанный. Наиболее вредными примесями являются соединения алюминия. Они приводят к значительному увеличению расхода хлора и засорению коммуникаций — хлористый алюминий конденсируется из газа в твердом виде в газоходах, пылеуловителях и других аппаратах. Содержание его в пыли, осадках фильтров, скрубберов и вентиляторов составляет 30—60%. Для уменьшения содержания алюминия в сырье, используемом для хлорирования, производят отмывку глины из руды или выделяют из руды соединения алюминия другими методами (например, флотацией). Аналогичным образом ведет себя и хлорное железо. Растворимость его 77 в TiCl4 равна 0,003% при 40° и 0,043% при 110°.
Основное количество образующегося MgCl2 (около 80%) извлекается из печного газа при очистке его от пыли и частично (около 15%) выходит из печи с плавом. Остальное количество MgCl2 отделяется с осадком при фильтрации жидкого четыреххлористого титана.
Для отделения хлоридов Fe2+, Мп2+ и Mg2+, плавящихся при 712—650°, предложено 78 охлаждать газы до 200—300° в верхней части печи, орошаемой суспензией твердого инертного материала (например, песка) в жидком четыреххлористом титане. Инертный материал вместе с конденсировавшимися на его частицах хлоридами железа, марганца и алюминия выгружают из зоны охлаждения, откуда также отводятся очищенные пары TiCl4.
Хлористый кальций в основном остается в печи и выходит вместе со шлаком. Возможно, что расплавленный шлак абсорбирует немного ИСЦ, который отгоняется при продувке шлака воздухом 79.
Соединения ванадия переходят в технический хлорид титана и отделяются лишь при очистке продукта.
Хлорирование титанистого сырья осуществляют в шахтных электрических печах периодического действия, а также в хлораторах непрерывного действия с применением в качестве рабочей среды расплава хлоридов. Хлорирование титанистого сырья возможно также осуществить в печи со взвешенным слоем 80~82.
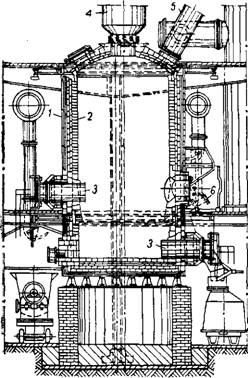
Электрическая печь (рис. 448) состоит из стального кожуха, футерованного изнутри плотным шамотным или динасовым кирпичом.
В нижней части печи помещаются два ряда (верхний и нижний) угольных электродов, по три электрода в каждом ряду. Про - странство между рядами электродов заполняют насадкой из угольных цилиндров, служащей электросопротивлением, с помощью
Которого в печи поддерживается необходимая температура.
Брикеты шихты загружают в печь периодически, так чтобы было заполнено пространство' над угольной насадкой. Хлор подают в печь по фурмам, расположенным под углом несколько выше нижнего ряда электродов. Газообразные продукты хлорирования вместе с непроре - агировавшим (избыточным) хлором выходят из верхней части печи и направляются в систему пылеочистки и для дальнейшей переработки. Вместо брикетов можно загружать в печь гранулы, приготовленные83 с применением в качестве связки бентонита и обожженные при 1000—1100°.
Предложено получать TiCU хлорированием порошкообразного сырья, содержащего окислы титана, в потоке хлора и окиси углерода 84. Отмечается благоприятное действие примеси СО к хлору при хлорировании в электрических печах85. Заслуживает внимания по - стадийное осуществление процесса хлорирования в двух или нескольких аппаратах86. В первом аппарате проводят хлорирование при пониженной температуре с образованием легко летучих хлоридов и хвостовых газов. После отделения хлоридов газы направляют во второй аппарат.
|
Рис. 448. Схема электрической шахтной печи для хлорирования титанистого сырья: / — кожух из листовой стали; 2—футеровка; 3 — угольный электрод; 4 — загрузочное устройство; 5 — труба для выхода газов; 6 — фурма для подачи хлора. |
В СССР помимо хлорирования брикетов из титановых шлаков и кокса в шахтных электрических печах периодического действия, четыреххлористый титан получают также хлорированием измель
ченных титановых шлаков и кокса, взвешенных в расплаве хлоридов, в хлораторах непрерывного действия.
Этот способ является весьма перспективным вследствие возможности осуществления процесса в высокоинтенсивных аппаратах непрерывного действия и уменьшения капитальных и эксплуатационных расходов. В качестве реакционной среды применяют расплавленный карналлит 87, а также смесь хлоридов калия и натрия или чистые хлориды, например, расплав NaCl88 для хлорирования смеси ТЮ2 и древесного угля при 900°. При содержании в расплаве ~2% хлорного железа интенсифицируется массопере - нос хлора к поверхности частиц двуокиси титана. Установлено89, что количество хлора, транспортируемого растворенным хлорным железом от поверхности пузырька к твердой хлорируемой поверхности, примерно в 100 раз больше количества растворенного хлора, транспортируемого через расплав. Аналогично действует также добавка в расплав хлористого алюминия90. При температурах выше 750° скорость процесса хлорирования тормозится массопередачей реагирующих веществ в расплаве, окружающем пузырек хлора и твердые частицы ТЮ2 и кокса91. Процесс может быть осуществлен в барботерах, снабженных механическими мешалками, аппаратах газлифтного типа и других, в которых не происходит осаждения твердых частиц суспензии.
Рекомендуют 92 хлорирование шлаков в расплавленных хлоридах проводить при пониженных температурах (650—750°) для увеличения накопления хлоридов железа в расплаве и уменьшения количества возгонов твердых хлоридов, затрудняющих работу аппаратов конденсации. Максимальная скорость хлорирования достигается при концентрации в суспензии 5—6% нефтяного кокса и 10—12% двуокиси титана (при средних размерах их частиц ~25 мк). При этом следует учитывать общую суммарную поверхность твердых частиц в расплаве, которая не должна превышать 280 000 см2/л расплава.
Состав рабочего расплава по количеству хлоридов калия и натрия необходимо регулировать так, чтобы при соответствующей температуре вязкость его не превышала 3,5 сп.
Недостатком способа хлорирования в расплавах хлоридов являются повышенные потери титана с возгонами, идущими в отвал. Из них 30—40% уносится в виде шихты из хлоратора и 10—12% приходится на долю окси - и гидрооксихлоридов титана, образующихся при взаимодействии TiCl4 с кислородом и парами воды при высокой температуре93. Уменьшения потерь можно достигнуть при использовании шихты более крупного помола, полной герметизации конденсационной системы и тщательной осушке сырья. Представляет также интерес дохлорирование возгонов на угольной насадке 94, разработанное применительно к получению хлоридов ниобия.
Жидкий четыреххлористый титан, полученный при охлаждении | продуктов хлорирования, содержит много примесей в виде твердых « взвешенных частиц и растворимых веществ.
С целью предотвращения осаждения хлорного железа и других £ примесей на теплопередающих поверхностях при охлаждении ре - I комендуют95 образующуюся суспензию взвесей в четыреххлори - | стом титане пропускать через охлаждающие устройства со ско - I, ростью 2—5 м/сек. |
Из продуктов хлорирования титанистых шлаков в расплаве § NaCl или отработанного магниевого электролита выделяются при их охлаждении в системе конденсации плавкие возгоны, затруд - ^ няющие отделение примесей. Установлено 96, что такие возгоны по - являются при уменьшении в расплаве концентрации ТЮг ниже I 0,8% и интенсивном испарении из расплава комплексных хлори - | дов (K, Na)FeCl4 и (К, Na)AlCl4, которые конденсируются в си - Р стеме охлаждения отходящих газов хлоратора. i
Хлориды железа и алюминия отделяются из жидкого TiCl4 вме - | сте с другими твердыми примесями при отстаивании или при филь - I тровании конденсата через пористые керамические фильтры или 1 активированный уголь. Содержание железа в хлориде титана после | фильтрации составляет не более 0,02%, а другие нерастворимые | примеси практически отсутствуют 97. $
Из отделенных примесей можно выделить FeCl3 путем расплав - * ления их при 350—450° под давлением, достаточным для предотвращения испарения хлорида98. После отстаивания расплава он расслаивается на три части — верхнюю, обогащенную углеродистыми частицами, нижнюю — частицами двуокиси титана и среднюю, состоящую в основном из хлорного железа. Нижнюю и верхнюю части выводят из зоны плавления и возвращают на хлорирование. Среднюю часть отводят в качестве продукта или окисляют до РегОз в присутствии кислорода.
При наличии в продукционных газах хлористого железа его можно выделить99 охлаждением до 500—550° в виде сухих стабильных кристаллов FeCb. Их отделяют от газового потока в циклон - S ном сепараторе. Из оставшейся газовой смеси конденсируют Т1СЦ. Отфильтрованный от твердых примесей конденсат — технический четыреххлористый титан имеет красновато-желтый цвет и содержит около 97—99% TiCl4, 1,5—2,5% SiCl4, 0,02—0,002% Fe, 0,1—0,3% С1 и 0,06—0,1% V. Хлор ограниченно растворим в TiCU I0°, a SiCU образует с TiCl4 непрерывный ряд жидких смесей (рис. 449).
Очистка технического продукта для получения TiCl4, пригодного для производства ковкого титана, производится при помощи меди с последующей дистилляцией образовавшихся продуктов. При вза - имодействии с порошком меди хлор, растворенный в Т1С14, связывается в хлорид ме'ди, а хлориды железа и ванадия, а также хлор - окись ванадия восстанавливаются до низших хлоридов, имеющих
Более высокую температуру кипения. (Температура кипения хлор - окиси ванадия незначительно отличается от температуры кипения четыреххлористого титана (127 и 136°), поэтому отделение VOCl3 от TiCU физическими методами затруднительно.)
После обработки медью четыреххлористый титан для удаления примесей подвергают двухступенчатой ректификации. Вначале отделяют наиболее низкокипящий компонент — четыреххлористый кремний, а хлорид титана накапливается в кубовом остатке. При повторной ректификации в дистилляте получается чистый четыреххлористый титан с содержанием ' 98,5—99% TiCU, а в кубовом остатке — примеси.
Предложено много способов обработки технического продукта, приготовления активной меди и очистки TiCU от примесей. Так, обработку конденсата можно осуществить пропусканием его в жидком или парообразном виде через колонну, заполненную медной стружкой, или путем размешивания его с порошком меди, полученным восстановлением окиси меди 101' 102.
Из образующейся пульпы отгоняют TiCl4 и выделяют ванадий и медь разными методами. Например103, обработкой щелочью для перевода в раствор ванадия и затем кислотой для извлечения меди. При пропускании паров TiCU через колонну с насадкой из измельченной меди соединения ванадия полностью задерживаются на меди 104'105. Для их извлечения и регенерации меди колонну можно периодически промывать разбавленной кислотой 104. Для увеличения активности металлической меди рекомендуется 106 обрабатывать ее летучими спиртами, альдегидами или кетонами с последующим испарением этих веществ под вакуумом. Активированную таким образом медь необходимо до употребления предохранить от соприкосновения с воздухом.
Разрушение хлорокиси ванадия можно, по-видимому, осуществить и при добавке 0,15—0,3% иода или иодидов 107-108 или при помощи сероводорода 10Э.
Предложены также методы очистки технического четыреххлористого титана, основанные на адсорбции примесей твердыми поглотителями 6. В качестве адсорбентов можно применять ламповую или газовую сажу, или древесный уголь. Четыреххлористый титан особо высокой чистоты, содержащий 4-10"6% примесей, можно получать при использовании трехслойного адсорбционного фильтра, состоящего из угля, алюмогеля и силикагеля по.
При пропускании паров четыреххлористого титана через насад, ку из углеродсодержащих реагентов одновременно с очисткой от ванадия протекает также очистка TiCU от хлора и кислорода111. Четыреххлористый титан высокой чистоты с содержанием 99,999 мол.% TiCl4112 может быть получен при перегонке очищенного продукта под разрежением. Возможна также очистка дистилляцией TiCl4 в присутствии небольшого количества минеральных масел (0,1—0,3 вес.%) с применением отдувки инертным газом113. Предложено очистку технического TiCl4, содержащего до 1 % VOCl3 и 0,5—3% TiCl3 (в суспендированном виде), производить с применением вазелинового масла114 в количестве 0,2—0,3 вес. ч. на 1 вес. ч. VOCl3 в исходном материале. Смесь нагревают при перемешивании и выдерживают 5—10 мин при 120—150°. Затем из нее отгоняют TiCl4. В получаемом продукте содержится меньше 0,01 вес.% VOCI3. При отсутствии в техническом TiCl4 примеси TiCl3 последний добавляют вместе с вазелиновым маслом в количестве 1,5— 2 вес. ч. на 1 вес. ч. VOCl3.