Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
ОКИСЛЯЕМОСТЬ СУЛЬФИТНЫХ СОЛЕЙ
Вследствие легкой окисляемости сульфитных солей (в особенности солей аммония) получаемые продукты — бисульфит, сульфит — содержат некоторые количества сульфата. Процесс окисления продолжается и при хранении продуктов. При хранении кри - гталлического сульфита в нем иногда накапливается до 20% сульфата. что делает продукт нестандартным. Крупнокристаллический сульфит лучше противостоит окисляющему влиянию атмосферы вследствие меньшей поверхности кристаллов, приходящейся на единицу веса. Его окисление усиливается во влажной атмосфере и под Действием света, а также в случае использования в производстве В°ДЫ, загоязнений ионами металлов43~45. В сухой атмосфере Na2S03-7H20 теряет кристаллизационную воду и переходит в безводный Na2S03, но не окисляется. На этом основании рекомендуется изготовлять безводный продукт и хранить его в условиях, препятствующих гидратации46.
В растворе окислительные процессы происходят, по-видимому, в результате цепной реакции. Начальными центрами цепи, возможно, являются одновалентные ионы SO3, образующиеся из ионов БОз" в результате потери ими отрицательного заряда (например, под действием ультрафиолетовых лучей). При этом образуется гипотетическая монотионовая кислота HSO3. В дальнейшем цепная реакция идет по следующей схеме:
HSO3 + 02 + Н20 + Sof- = 2S02- + ОН" + 2Н+ ОН + So!-- + Н+ = HS03 + ОН" и т. д.
. Обрыв цепи в отсутствие кислорода происходит в результате димеризации 2S03 = S206~ — образуется стабильная дитионовая кислота.
Образование сульфата в бисульфите в процессе его изготовления тем меньше, чем больше концентрация S02 в газовой смеси, так как на количественную сторону окисления влияет главным образом длительность процесса. Наиболее сильное окисление происходит при рН раствора 7—9, т. е. при регенерации раствора и удалении S02. Этому способствует также повышение температуры. В диапазоне 25—100° скорость разложения возрастает в 25 раз. Значение рН для чистого раствора бисульфита аммония по разным - данным находится в пределах 2,2—4,7; вероятное значение 3,5 47-48. Ьб окислении сульфитов кальция и магния и бисульфита магния см.49'50.
Окисление сульфита кислородом при рН = 5 — 8 протекает, как реакция второго порядка, а при меньших и больших значениях рН — как реакция первого порядка. В присутствии сильных окислителей, например двуокиси марганца, окисление сульфита значительно ускоряется, причем максимум скорости наблюдается в кислой среде, при рН = 4 61—54 При поглощении кислорода раствором сульфит-бисульфита аммония окисляются и SO3- и HSO3, но преимущественно бисульфит. Несмотря на это, содержание его в растворе не изменяется, а содержание сульфита уменьшается. Это объясняется тем, что образующийся при окисленииНЭОз HohHSOI. являясь более сильной кислотой, реагирует с сульфитом, вновь образуя бисульфит, так что из раствора исчезают только ионы S03-- В диапазоне изменения содержания бисульфита 63—100% от суммы сульфита и бисульфита скорость окисления раствора возрастает приблизительно в 6 раз. Когда в растворе сверх бисульфита содержится свободная сернистая кислота, т. е. значение рН (детвора понижено, скорость окисления резко падает до нуля. Скорость поглощения кислорода раствором сильфит-бисульфита аммония [Go,, Г/(м2^ч)], эквивалентная скорости образования сульфата аммония, может быть вычислена по формуле
Lg GO2 = 6lg-^- + 0,325
Где S — содержание SO2 в сульфите и бисульфите, г-мол/л;
С — содержание NHb в сульфите и бисульфите в пределах 7,5—3 г-мол/л, при постоянном общем содержании NH3 в растворе в виде сульфита, бисульфита, сульфата, тиосульфата и тритионата, равном 8 г-мол/л. Для С<3 г-мол/л-.
LgOo2 = 61g-^- + 0,118
Эти формулы выведены55 для поверхностной абсорбции кислорода сравнительно концентрированными растворами и отличаются
|
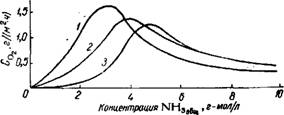
Рис. 154, Изохроиы скоростей поверхностного поглощения кислорода воздуха растворами сульфит-бисульфита аммония при 20—22° и при начальном CsoJCNHs = 0,78—0,8. |
От кинетических закономерностей, наблюдаемых для разбавленных растворов в иных гидродинамических условиях56_59. По мере увеличения общей концентрации солей скорость поглощения кислорода вначале возрастает, затем убывает (рис. 154). Максимум наблюдается при общей концентрации солей 2—3 г-мол/л, но смещается в сторону больших значений этой концентрации с увеличением относительного количества сульфата (изохроны 2 и 3 для больших значений времени располагаются правее, чем /). Наличие максимума, очевидно, объясняется тем, что в разбавленных растворах процесс окисления лимитируется скоростью реакции в растворе, а в концентрированных — скоростью абсорбции кислорода из воздуха. С увеличением парциального давления кислорода скорость окисления возрастает60, но абсолютный прирост концентрации SO4- в растворе зависит от того, какая стадия лимитирует общую скорость процесса. Так, в пенном аппарате скорость поглощения S02 в 10—15 раз больше, чем в насадочном скруббере, а скорость поглощения кислорода — в 2—3 раза. В итоге степень окисления раствора в пенном аппарате в 5 раз меньше, чем в насадочном скруббере61.
В результате обобщения производственных данных предложена 62 эмпирическая формула для определения скорости окисления растворов сульфит-бисульфита аммония, натрия, кальция, магния в процессе извлечения S02 из газов в скрубберах с насадкой (хордовой, реечной или из керамических колец):
|
|
//Здесь Go2 — скорость поглощения кислорода, г/{м2-ч), отнесенная к 1 м2 поверхности насадки; T — температура, °С; Q — плотность орошения, мъ!{м2-ч) у — плотность раствора, кг/мъ ц—вязкость раствора, кг-сек/м2; S/C— среднее молярное отношение содержания S02 в жидкой фазе к содержанию связанного с ним основания.
Это уравнение получено для следующих пределов изменения условий: Q — от 52 до 2, T — от 50 до 25°, у — от 1 до 1,3, м - — от 1,1 до 3, S/C — от 0,7 до 0,9, скорости газа в полном сечении скруббера— от 0,3 до 3 м/сек, исходной концентрации S02 в газе — от 0,06 до 0,35 объемн.%, содержание кислорода в газе —от 8 до 19 объемн.%, общего содержания растворенного S02 (в виде суль - фит-бисульфитных солей) —от 0,016 до 7 моль/л, рН раствора — от 4,0 до 6,0.
Окислительные процессы могут быть подавлены введением в производственные растворы отрицательных катализаторов — веществ, каталитически препятствующих окислению, антиокислителей или ингибиторов. Механизм ингибиторного действия объясняют образованием комплексов из молекул реагента и ингибитора. Так, при ингибировании спиртами процесса окисления S02 воздухом образуются комплексные соединения между S02 и спиртом. По эффективности ингибиторного действия фенолов на реакцию окисления слабых водных растворов NaHS03 при 40—60° их можно расположить в следующий ряд: гидрохинон > пирогаллол > (5-наф - тол > а-нафтол > пирокатехин > резорцин > фенол > флороглю - цин. Особенно эффективными антиокислителями являются диме - тилпарафенилендиамин и парафенилендиамин — они предохраняют от окисления даже при концентрации 1 :200 000 61_б5. Следы окислов азота сильно ухудшают действие ингибиторов 66.
Накопление сульфата в производственных растворах при обработке их сернистым газом происходит не только за счет их окисления, но и вследствие поглощения SO3, обычно содержащегося в сернистом газе.