Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
Обезвоживание мирабилита высаливанием
Извлечение сульфата натрия из его растворов может быть осуществлено методами высаливания, основанными на понижении растворимости сульфата со смещением переходной точки в присутствии других веществ.
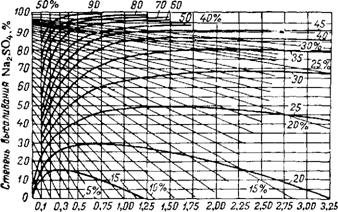
Наиболее дешевый высаливающий реагент—NaCl; к тому же он часто является естественной примесью к сульфатным растворам. На рис. 35 изобоажена политермииеская диаграмма равновесия для системы Na? SOd—NaCl—Н^О (содержание Na2S04 и NaCl дано в сухом остатке). Если в отсутствие NaCl точка перехода Na.>S04-ЮН<>0 в Na? S04 лежит ппи 32.38®, то при добавке NaCl'температура перехода уменьшается и становится равной 17,Q®. когда содержание NaCl в растворе достигает 22.3%. В этой тпойиой точке А в солевой массе эвтонического раствора 25.4% Na2S04 и 74,6% NaCl, а сам раствор содержит всего 7.57%
Na2S04, В ТО время как в точке В в насыщенном растворе 33,2% Na2S04. Ниже 17,9° выделение в осадок безводного Na2S04 не происходит, а при повышении температуры поле кристаллизации Na2S04 несколько расширяется и степень его высаливания увеличивается. Так, при 50° в отсутствие NaCl растворимость Na2S04 составляет 31,9%, а эвтонический раствор содержит 23,89% NaCl и всего 5,17% Na2S04 (в сухом остатке 17,8% Na2S04 и 82,2% NaCl).
Таким образом, добавка к растворам сульфата натрия NaCl приводит к кристаллизации Na2S04 и позволяет получить в безводном виде значительную долю сульфата. После отделения Na2S04 отстаиванием и фильтрованием остающийся маточный раствор может быть подвергнут выпариванию для кристаллизации из него NaCl, возвращаемого на высаливание. Отфильтрованный сульфат для удаления из него примеси NaCl необходимо промыть насыщенным раствором Na2S04 (в 1,5-кратном количестве к твердой фазе) 89.
Способ высаливания сульфата натрия галитом используется на предприятии имени Тельмана в ГДР. Расчетные расходные коэффициенты применительно к обезвоживанию этим способом Аральского сульфата натрия следующие (на 1 г сульфата): галита --0,65 т, пара 0,88 т, электроэнергии 36 кет ■ ч, Условного топлива 0,015 т. Этот способ получения безводного сульфата натрия экономически оправдывается при использовании дешевого отбросного галита, не добываемого специально для высаливания.
В качестве высаливающих реагентов для выделения безводного сульфата натрия из растворов могут быть использованы смеси солей: NaCl + KCI122, NaCl + MgS04, а также Na2S, NaOH и др.
|
32,38" |
|
100 Na2SQ4 |
|
Рис. 35. Проекционная политермическая диаграмма равновесия в системе Na2S04—NaCl—Н20. |
При использовании в качестве высаливающего средства едкого натра вода, содержащаяся в сульфатном растворе, из которого высаливается Na2S04, разбавляет раствор NaOH и должна быть удалена из него выпариванием. После выпаривания концентрированный раствор NaOH вновь возвращается на высаливание. Преимущество этого способа по сравнению со способом непосредственной выпарки сульфатных растворов заключается в том, что при выпарке растворов NaOH греющая поверхность не инкрустируется
Сульфатом натрия, хотя и происходит его дополнительная кристаллизация по мере увеличения концентрации NaOH 123.
В табл. 14 приведена растворимость Na2S04 в водных растворах едкого натра при разных температурах.
ТАБЛИЦА 14
|
Растворимость Na2S04 в водных растворах NaOH
|
|
По диаграмме рис. 36 можно определить степень высаливания Na2SC>4 из его насыщенного раствора при 60° растворами NaOH |
|
Количество раствора NaOH, Л/ л насыщ. раствора сульфата Рис. 36. Степень высаливания Na2S04 из его насыщенного раствора при 60° растворами NaOH разной концентрации: — концентрация исходного раствора NaOH, %. концентрация NaOH в жидкой фазе получаемой суспензии |
Раяной концентрации. При смешении 0,4—1 объема 40—50%-ного раствора NaOH с 1 объемом насыщенного раствора сульфата натрия степень высаливания Na2S04 составляет 85—90%, а раствор
После отделения осадка сульфата содержит 20—25% NaOH и 2,5—5% Na2S04.
Непосредственное растворение твердого мирабилита в растворе едкого натра приводит к образованию тонкодисперсного осадка Na2S04, трудно отделяемого от жидкой фазы. Лучшие результаты получаются при предварительном расплавлении мирабилита. Нагреванием мирабилита до 60° можно выделить 42% сульфата натрия. При смешении отделенного от кристаллов раствора с равным объемом 40%-ного раствора NaOH высаливается еще 52% Na2S04. Наконец, при выпаривании полученного разбавленного раствора щелочи выделяются остальные 6% Na2S04.
Для получения в процессе плавления крупнокристаллического, хорошо фильтрующего безводного сульфата натрия плавление необходимо вести медленно при перемешивании массы с такой интенсивностью, чтобы выделяющийся безводный Na2S04 оставался во взвешенном состоянии. Затем суспензия должна быть нагрета до 70—85°. При соблюдении этих условий образуется осадок с размерами кристаллов 200—250 мк, оседающий при 85° со скоростью 8—9,5 ж/ч. В процессе высаливания крупнокристаллический, хорошо фильтрующий осадок образуется при медленном приливании нагретого до 70—80° раствора NaOH к нагретому до этой же температуры, интенсивно перемешиваемому раствору сульфата натрия.
Находящиеся в сульфате натрия примеси соединений магния, полуторных окислов, кремневой кислоты и другие образуют в растворе едкого натра гелеобразные осадки, затрудняющие отстаивание и фильтрацию кристаллов Na2S04. Поэтому эти примеси должны быть отделены до высаливания. При этом возможно получение продукта, содержащего до 99,5% Na2S04 (в пересчете на сухое вещество).
Предложено 124 получать безводный сульфат натрия из мирабилита нагреванием последнего в смеси с двойной солью Na2S04- • NH4HCC>3 • 4Н20 до 60°. Образующийся осадок NaaS04 отфильтровывают, а из фильтрата охлаждением до 20° выделяют Na2S04- •NH4HC03-4H20. Концентрированием маточного раствора, остающегося после отделения четырехводной двойной соли, кристаллизуют сульфат аммония.