Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
ЧЕТЫРЕХХЛОРИСТЫЙ ТИТАН Физико-химические свойства20-21
Четыреххлористый титан ИСЦ при 20° — бесцветная жидкость с плотностью 1,27 г/см3, замерзающая при —23° и кипящая при 136°. При загрязнении низшими хлоридами, а также хлориым железом, оксихлоридом ванадия и другими он приобретает желтую окраску. Во влажном воздухе его пар гидролизуется с образованием густого белого дыма:
TiCl4 + ЗН20 = H2Ti03 + 4НС1
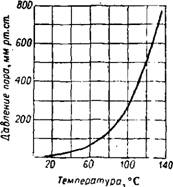
Давление пара TiCU (в мм рт. ст.) Может быть вычислено по формуле IgP = 7,64433— 1947,6 Г-i (рис. 444).
В присутствии водорода при 500— 800° четыреххлористый титан образует фиолетовый треххлористый титан, а при избытке водорода — двуххлори - стый титан; при большом избытке водорода и повышении температуры до 900—1000° восстановление идет до металлического титана.
Аналогично четыреххлористый титан восстанавливается и другими восстановителями, например, магнием, алюминием. В присутствии кислорода при 600—1000° четыреххлористый титан окисляется с образованием молекулярного хлора:
TiCl4 + 02 = ТЮ2 + 2С12
Прежние сведения о частичном образовании при этом оксихло - рида
4TiCl4 + ЗОа = 2Ti203Cl + 6С12
Экспериментально не подтвердились22.
|
Рис. 444. Давление пара над жидким TiC]4. |
Четыреххлористый титан бурно реагирует с водой с выделением большого количества тепла. Вначале образуются гидраты, а затем начинается гидролиз с образованием метатитановой кислоты Н2ТЮ3 и соляной кислоты. В избытке воды образуется пятиводный четыреххлористый титан TiCl4-5H20, а при низких температурах
и недостатке воды — двухводный TiCl4-2H20, а иногда и одновод - ный кристаллогидрат — TiCl4-H20. При взаимодействии с парами воды продуктами реакции до 450° являются окси - и гидрооксихло - риды титана, при более высоких температурах (~750°)— двуокись титана:
TiCl4 + 2Н20 = ТЮ2 + 4НС1
С повышением температуры в продуктах гидролиза уменьшается содержание оксихлоридного титана и увеличивается содержание двуокиси титана, В этой системе существует непрерывный ряд соединений с плавным изменением в их составе атомного отношения титана и хлора. Предложено состав основных хлоридов четырехвалентного титана, образующихся при взаимодействии с парами воды, выражать формулами 23:
ТЮа(ОН)2_2аС12 (где я = 0 + 1) Т1(ОН)лСЦ_д. • FiHjO [где * : (4 - х) - 1 - ь 3]
Основные хлориды титана — термически нестойкие соединения; полученные при комнатной температуре они начинают разлагаться уже при 50—60° и полностью переходят в двуокись титана выше 300°. На воздухе постепенно разлагаются под влиянием влаги. Растворимость основных хлоридов в воде и 5% - ной серной кислоте тем больше, чем ниже температура их образования.
В четыреххлористом титане они образуют структурированные взвеси вследствие анизодиаметрической формы частиц и высокой их дисперсности24.
Из аналогов четыреххлористого титана наибольшее значение в металлургии титана сверхвысокой частоты имеют иодиды титана 25_2S.
Применение
Четыреххлористый титан имеет большое значение как сырье для производства металлического титана 2Э~33, находящего применение в качестве конструкционного материала, в частности в химической промышленности и ядерной технике34'35.
Получение чистого металла из четыреххлористого титана проще, чем восстановление его из кислородных соединений из-за большого сродства титана к кислороду36'37. При содержании же больше 0,2% кислорода титан теряет способность к пластической деформации. Из четыреххлористого титана можно получать ковкий титан с минимальным количеством примесей — магнийтермическнм (восстановление TiCl4 магнием), натрийтермическим (восстановление TiCl4 натрием) и электрохимическим методами6■ 38_4°, Наиболее освоенным и эксплуатируемым в промышленных условиях является магнийтермическое восстановление TiCl4.
В связи с расширяющимся производством титана и уменьшением его стоимости перспективным является применение его в качестве декоративного материала в строительстве41. Улучшение внешнего вида его поверхности и придание ей разнообразных оттенков возможно методами механической полировки, анодирования, термического травления, а также никелирования 42 и др.
Титанокарбидные сплавы характеризуются меньшей температурой резания и меньшим коэффициентом трения, чем вольфрамокар - бидный сплав. Поэтому они пригодны для обработки высокопрочных и жаростойких материалов. Основные достоинства титанокарбидных сплавов заключаются в высокой твердости и очень высоком сопротивлении абразивному износу43. Во многих электролитических процессах применяют титановые аноды вместо платины или других благородных металлов. Показана44 возможность электрохимического получения двуокиси марганца с использованием титановых анодов.
В лакокрасочной промышленности четыреххлористый титан используют для получения двуокиси титана 45~49. При взаимодействии раствора TiCl4 с аммиаком и концентрированной серной кислотой образуется двойная соль (NH4)2S04-Ti0S04-2H20, из которой можно получить легкую двуокись титана (с кажущейся плотностью 0,25 г! см3), пригодную для синтеза драгоценных камней50. Четыреххлористый титан является интенсивным дымообразовате - лем, используемым в военном деле51. Образование дыма происходит в результате гидратации и гидролиза TiCl4 водяными парами, находящимися в воздухе, и значительно интенсифицируется в присутствии аммиака.
Сырье6>36
Содержание титана в земной коре составляет 0,6 вес. %; по весу он занимает четвертое место среди наиболее распространенных конструкционных металлов (после алюминия, железа и магния).
Несмотря на распространенность, скопления титановых соединений встречаются редко. Наиболее распространенные титановые минералы — ильменит и титаномагнетит, рутил, перовскит и сфен, или титанит. Ильменит РеТЮз — метатитанат железа — впервые был найден на Урале в Ильменских горах. При его выветривании образуются тонкодисперсные окислы титана и железа.
Электромагнитным разделением магнетита и ильменита получают ильменитовый концентрат (слабомагнитная фракция), железный концентрат (магнетитовый) и хвосты (немагнитная фракция). Двуокись титана встречается в магматических горных породах в трех модификациях — рутил, анатаз и брукит, из которых наиболее распространенной является рутил. Встречаются также концентрированные месторождения рутила осадочного типа на морском побережье, образовавшиеся при распаде горных пород.
Рутил, освобожденный от пустой кремнистой породы47, является наиболее концентрированным титановым сырьем. Он содержит от 91 до 99% ТЮ2 с небольшими примесями циркония, ниобия, ванадия, хрома, железа, кремния и алюминия.
В СССР имеются крупные месторождения перовскита — титаНата кальция СаТЮ3.
Сфен, или титанит — титаносиликат кальция СаО • ТЮг - Si02, в котором часть СаО может замещаться на FeO и MgO. Источником титана могут также служить руды, содержащие комплексные минералы — лопарит, пирохлор и другие титано-ниобиево-тантало - вые минералы.
Ильменит в настоящее время является основным видом титанового сырья.
В 1963 г. добыча ильменита в капиталистических странах составила 52 больше 2 млн. г, а рутила — 0,2 млн. т.
В табл. 115 приведен примерный состав титановых руд6'63.
|
ТАБЛИЦА 115 Содержание главных компонентов в титановых рудах (Содержание компонентов в %)
|
В связи с малым содержанием примесей в рутиловом концентрате получение TiCU из этого вида сырья проще, чем» при использовании ильменита. Однако рутил — более дорогое и менее распространенное сырье.
Непосредственное хлорирование ильменита затрудняется образованием большого количества хлорного железа. Поэтому ильменит до хлорирования подвергают обезжелезиванию.