Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
Бикарбонатный способ получения магнезий
Путем дальнейшей химической обработки продуктов обжига магнезита и доломита можно получить из них легкие формы магнезий. Одним из методов такой обработки является перевод малоактивной окиси магния в раствор в форме бикарбоната магния с последующим осаждением из него активной магнезии. Окись магния, полученную при обжиге магнезита, размалывают и гасят водой. Образующуюся суспензию—магнезиальное молоко подвергают карбонизации двуокисью углерода в автоклавах под давле
нием выше 5 ат. При этом образуется раствор бикарбоната магния
Mg(OH), + 2С02 = Mg(HC03)2
Который после отделения от твердых примесей при дальнейшем кипячении гидролитически разлагается:
2Mg(HC03)2 = MgCOa + Mg(OH)2 + 3C02 + Н20
Образующийся осадок основного карбоната магюия отделяют и после сушки получают в виде тончайшего порошка — магнезии альба.
|
Время |
|
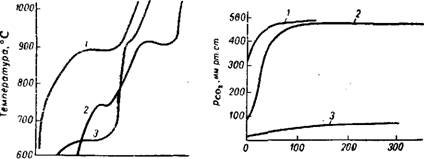
Рис. 89. Термограммы диссоциации карбонатов кальция и Могняя в атмосфере С02 при нормальном давлении: I — известняк; 2 — доломит; 3 — магнезит. |
|
Время, мин |
|
Рис. 90. Скорость диссоциации доломита при 620°: / —е добавкой NaF; 2-е добавкой NaCl; 3— без добавки. |
Аналогичным путем получают магнезию и из доломита. При обжиге диссоциация доломита
MgCOj • СаСОз = MgO + СаО 2СО., - 74 кка?
Протекает в две стадии (рис. 89). Разложение MgC03 доломита происходит при ~730°, т. е. на ~80° выше, чем разложение MgC03 магнезита. Это обусловлено тепловым эффектом образования CaMg(C03)2. Опытным путем установлено отсутствие стадии предварительного распада доломита на образующие его карбонаты110. При 730° доломит разлагается с образованием MgO и твердого раствора карбонатов, обедненного углекислым магнием111: «CaMg(C03)2 = (я — 1 )MgO + MgC03 • яСаС03 + (я — 1)С02
Повышением температуры до 910° достигается дальнейшая диссоциация твердого раствора:
MgC03 • яСаС03 = MgO + «СаО + (п + 1 )С02
Скорость диссоциации доломита меньше, чем магнезита; ©на увеличивается в присутствии 1% фторида или хлорида натрия
(рис. 90 ) 32-112«пз. Обжиг доломита ведут при 700—800° или 1100—1250° в зависимости от назначения получаемого продукта. При неполном обжиге разлагается лишь MgC03 и получается так называемый полуобожженный доломит. Его можно, в частности, получить при быстром нагревании доломита в закрытой зоне вращающейся печи до 750—800° в атмосфере С02 в течение 15 мин и Дальнейшем охлаждении до 500° в течение 30 мин 114.
При гашении водой полностью обожженного доломита образуется суспензия гидроокисей магния и кальция:
(MgO + СаО) + 2Н20 = Mg(OH)2 + Са(ОН)2
|
£ |
|
8 12 16 20 24 2S 32 36 Время гидратации, сутки |
|
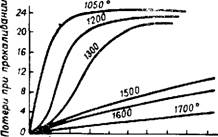
Рис. 91. Скорость гидратации окиси магния, обожженной .при разных температурах. Начальная влажность 25%; температура 20°. |
Скорость гидратации MgO уменьшается с повышением температуры обжига и особенно резко выше 1300° (рис. 91); она умень-
Шается также в присутствии примесей СаО, Si02, А1203 и других и зависит от размеров частиц окиси магния115. При отстаивании суспензии гидроокись магния оказывается в верхнем слое, что позволяет производить этим методом грубое отделение ее от других твердых компонентов. Небольшие добавки MgCl2 ускоряют гидратацию, но при этом возможно образование оксихло - ридов "6.
Для получения относительно крупных кристаллов Mg(OH)2 в суспензии гашение ведут при 95—100°, нагре- твердой фазы, острым паром.
Вая пульпу, содержащую ~17% Для разделения гидроокисей магния и кальция пульпу разбавляют до содержания твердой фазы 11%, охлаждают до 60° и подвергают карбонизации. При этом Са(ОН)2 переходит в CaC03, a Mg(OH)2 остается без изменения:
Са(ОН)2 + Mg(OH)2 + С02 = СаСОз + Mg(OH)2 + Н20
В интервале 40—60° карбонизация гидроокиси кальция идет с максимальной скоростью. Осаждение СаС03 осуществляют в стальных аппаратах под атмосферным давлением, подавая в них турбо - газодувками газ из обжиговых печей, содержащий до 40% С02. Конец карбонизации гидроокиси кальция определяют по электропроводности пульпы —после окончания карбонизации Са(ОН)2 электропроводность резко увеличивается вследствие начала карбонизации Mg(OH) 2 32. Полученную пульпу направляют на дальнейшую карбонизацию, причем образуется раствор бикарбоната маг
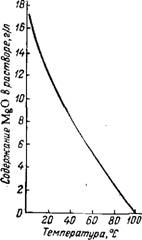
Ния. Растворимость MgO в, воде, насыщенной двуокисью углерода, показана на рис. 92. Во избежание выделения в осадок карбоната магния при получении бикарбоната магния температуру не поднимают выше 26°. Бикарбонатный раствор, отделенный от шлама (СаС03, Si02 и др.), разлагают, нагревая его при перемешивании до 45—50°. При этом образуется основной карбонат магния 3MgC03 • Mg(OH)2, который высушивают и выпускают в качестве легкой магнезии. Очистка раствора от соединений железа и марганца может быть осуществлена добавкой к раствору гидратированного углекислого магния 117.
|
Рис. 92. Растворимость MgO в воде, насыщенной двуокисью углерода. |
Скорость растворения Mg(OH)2 при карбонизации водной суспензии определяется скоростями процессов растворения и гидратации двуокиси углерода "8. Практически скорость карбонизации гидроокиси магния зависит от интенсивности перемешивания суспензии и от парциального давления С02 в газе. Оптимальное давление С02 — 2,5—3 ат; при таком давлении растворяется 80—90% MgO и образуется пересыщенный раствор бикарбоната, содержащий 25—30 г/л MgO. Добавка к магнезиальной суспензии 25 г/л MgS04-7H20 облегчает растворение MgO и способствует стабилизации пересыщенного бикарбонат - ного раствора 11В. Средняя скорость растворения гидроокиси магния и концентрация образующегося пересыщенного раствора Mg(HC03)2 растут с увеличением концентрации MgO в суспензии до 30 г/л, а затем уменьшаются. На степень возможного пересыщения раствора сильно влияют также размеры частиц гидроокиси магния, зависящие от условий обжига исходного магниевого минерала (прежде всего от температуры обжига120). При карбонизации полуобожженных доломитов наблюдается большая растворимость бикарбоната магния при малой длительности карбонизации (вследствие пересыщения раствора), но с увеличением продолжительности процесса содержание его в растворе уменьшается, а в осадок выделяется основная углекислая соль магния, смешивающаяся с нерастворимыми составными частями доломитов121. В суспензии обожженного доломита при обработке С02 под давлением образуется двойная соль Mg(HC03)2 • MgC03; при давлении 16 ат в твердой фазе находится MgC03-3H20, а в растворе Mg(HC03)2; при 60 ат выделяется в осадок MgC03, а количество магния в растворе — 24 г/л (в пересчете на MgC03 • ЗН20)122.
Декарбонизация раствора бикарбоната магния с получением основной соли ускоряется при продувке через раствор воздуха. Однако этот воздух значительно снижает концентрацию выделяющейся в этом процессе двуокиси углерода, что затрудняет ее возврат на карбонизацию. Поэтому вначале разложение раствора ведут только при механическом перемешивании с использованием выделяющегося газа. После снижения концентрации MgO до 4 г/л Через раствор начинают продувать воздух, причем выделяющийся газ выбрасывают в атмосферу.
Для получения основного карбоната магния разложение бикар - бонатного раствора ведут при температуре выше 45°, потому что при 25° из пересыщенного метастабильного раствора Mg(HC03)2 выделяется не основная соль, a MgC03 • ЗН20 (кристаллы ромбической системы), а при 10° —MgC03-5H20 (кристаллы моноклинной системы); превращение MgC03-5H20 в MgC03-3H20 происходит при 13,9° 12°-123-125. Предложено производить разложение би - карбонатного раствора, «мгновенно» нагревая его до 100° инжектированием струей пара в реакционную камеру, где в мельчайших капельках раствора образуются частицы со средним размером ~2 мк, имеющие состав 5MgO • 4С02 • Н20, т. е. 4MgC03* • Mg(0H)2123. Предложено также обрабатывать раствор Mg(HC03)2 при 80—90° 2—5%-ным щелочным или канифольным мылом; выделяющийся при этом осадок основной соли MgC03 • Mg(OH)2, зерна которого покрыты мылом, рекомендуется в качестве наполнителя для резиновых смесей 126.
Карбонизацию суспензий, содержащих Mg(OH)2, с последующим разложением Ме(НСОяЬ можно использовать и для очистки технических окиси или гидроокиси магния; в этом случае после отделения примесей от раствора Mg(rIC03)2 его высушивают и прокаливают или прокаливают полученную из него магнезию. При энергичном перемешивании раствора бикарбоната магния с водной суспензией гидроокиси магния ниже 50° получается карбонат магния:
MgfHCOj)2 + Mg(OH), = 2MgC03 + 2Н20
Для увеличения активности рекомендуется выдерживать его при температуре ниже 27° 127.
Из руд, содержащих брусит (MgO • Н20) можно извлекать окись магния выщелачиванием раствором, насыщенным СОо и S02 (рН = 4,5—5,5); при повышении рН полученного раствора MgHS03 до ~9 добавкой MgO или Mg(OH)2 осаждается MgS03-6H20, который затем перерабатывают в окись магния с регенерацией S02. Часть окиси магния возвращают в процесс 128.
Предложено 129 получать окись магния из обожженного магнезита или брусита циклическим способом с помощью этаноламина. Исходный материал диспергируют при 30° в течение 8 мин в про- карбонизированном 30%-ном растворе моноэтаноламина. После отделения от шлама на фильтре остается пересыщенный раствор (15—17 г/л MgO). Через 45—50 мин из него начинает выделяться чистый MgCOa, который отфильтровывают и прокаливают, а фильтрат вновь насыщают двуокисью углерода и возвращают в цикл. Продукт содержит больше 95% MgO.