ТЕОРИЯ ГОРЕНИЯ И ТОПОЧНЫЕ УСТРОЙСТВА
ТЕОРИЯ ГЕТЕРОГЕННОГО ГОРЕНИЯ
При горении твердого топлива самой химической реакции предшествует процесс подвода окислителя к реагирующей поверхности. Следовательно, процесс горения твердого топлива является сложным гетерогенным физико-химическим процессом, состоящим из двух стадий: подвода кислорода к поверхности топлива турбулентной и молекулярной диффузией и химической реакции на ней.
Рассмотрим общую теорию гетерогенного горения на примере горения сферической частицы углерода, принимая следующие условия. Концентрация кислорода по всей поверхности частицы одинакова; скорость реагирования кислорода с углеродом пропорциональна концентрации кислорода у поверхности, т. е. имеет место реакция первого порядка, что для гетерогенных процессов наиболее вероятно; реакция протекает на поверхности частицы с образованием конечных продуктов сгорания, а вторичные реакции в объеме, а также и на поверхности частицы отсутствуют.
В такой упрощенной обстановке скорость горения углерода можно представить зависящей от скорости двух основных его стадий, а именно от скорости подвода кислорода к межфазщш поверхности и от скорости самой химической реакции, протекающей на поверхности частицы. В результате взаимодействия этих процессов наступает динамически, равновесное состояние между количеством доставляемого диффузией и расходуемого на химическое реагирование кислорода при определенной величине его концентрации на поверхности углерода.
Скорость химической реакции /(°2 г кислорода/(см2-с), определяемая
Как количество кислорода, потребляемого единицей реакционной поверхности за единицу времени, может быть выражена в следующем виде:
= кС3. (15-1)
В уравнении:
К — константа скорости химической реакции;
Св — концентрация кислорода у поверхности частицы.
С. другой стороны, скорость горения равна удельному потоку ки
Слорода к реагирующей поверхности, доставляемого диффузией:
К°' = ад(С, - С5). (15-2)
В уравнении:
Ад-—коэффициент диффузионного обмена;
Со — концентрация кислорода в потоке, в котором сгорает частица углерода.
Подставив значение Св, найденное из уравнения (15-1), в уравнение (15-2), получим следующее выражение для скорости гетерогенного горения через количество кислорода, потребляемого единицей поверхности частицы за единицу времени:
' . С° , ■’ (15-3)
И СХд
Обозначая через
Ккаж — - Ц - , (15-4)
. А ад
Можно выражение (15-3) представить в виде
/<°’ = /СкажС„. (15-5)
По своей структуре выражение (15-5) подобно кинетическому уравнению (15-1) реакции первого порядка. В ней константа скорости реакции "£• заменена коэффициентом Ккаж, который зависит как от реакционных - свойств горючего, так и от закономерностей переноса и поэтому назван кажущейся константой скорости горения твердого углерода.
Скорость химических реакций горения зависит от природы топлива и физических условий: концентрации реагирующего газа на поверхности, температуры и давления. Температурная зависимость скорости химической'реакции является наиболее сильной. В области низких температур скорость химической реакции мала и по потреблению кислорода во много; раз меньше скорости, с которой кислород может быть доставлен диффузией. Процесс горения ограничивается скоростью самой химической реакции и не зависит от условий подвода кислорода, т. е. скорости воздушного потока, размера частиц и т. д. Поэтому эта область протекания гетерогенного горения называется кинетической.
330
В кинетической области горения ад>-£, поэтому в формуле (15-3) величиной 1/ад можно пренебречь по сравнению с 1/& и тогда получим:
К°32 = кС0. (15-6)
|
Рис. 15-1. Области протекания Гетерогенной реакции. |
 Равновесие между количеством доставляемого диффузией и расходуемого на реакцию кислорода устанавливается при малом градиенте его концентрации, благодаря чему величина концентрации кислорода на реакционнной поверхности мало отличается от его значения в потоке. При высоких температурах кинетическое горение может наступать при больших скоростях воздушного потока и малых размерах частиц топлива, т. е. при таком улучшении условий подвода кисловода, когда последний может быть доставлен в значительно большем количестве 'по сравнению с потребностью химической реакции.
Равновесие между количеством доставляемого диффузией и расходуемого на реакцию кислорода устанавливается при малом градиенте его концентрации, благодаря чему величина концентрации кислорода на реакционнной поверхности мало отличается от его значения в потоке. При высоких температурах кинетическое горение может наступать при больших скоростях воздушного потока и малых размерах частиц топлива, т. е. при таком улучшении условий подвода кисловода, когда последний может быть доставлен в значительно большем количестве 'по сравнению с потребностью химической реакции.
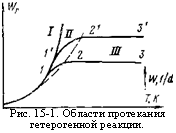
Различные области протекания гетерогенного горения графически изображены на рис. 15-1. Кинетическая область I характеризуется кривой 1, которая показывает, что с ростом температуры скорость горения резко возрастает согласно закону Аррениуса.
|
1, 1' — кинетическая; 2, 2' — промежуточная; 3, 3' — диффузионная. |
![]() При некоторой температуре скорость химической реакции становится соизмеримой со скоростью доставки кислорода к реакционной поверхности и тогда скорость горения становится зависящей не только от скорости химической реакции, но и от скорости доставки кислорода. В этой области, называемой промежуточной (рис. 15-1, область II, кривая 1—2), скорости протекания этих двух стадий соизмеримы, ни одной из них нельзя пренебречь и поэтому скорость процесса горения определяется формулой (15-3). С увеличением температуры скорость горения увеличивается, но в меньшей степени, чем в кинетической области, причем рост ее постепенно замедляется и, наконец, достигает своего максимума при переходе в диффузную область (рис. 15-1, область III, кривая 2—3), оставаясь далее не зависящей от температуры. При более высоких температурах в этой области скорость химической реакции настолько возрастает, что доставляемый диффузией кислород мгновенно вступает в химическую реакцию, в результате чего концентрация кислорода на поверхности становится практически равной нулю. В формуле (15-3) можно пренебречь значением 1/& по сравнению с 1/ад, тогда получим, что скорость горения определяется скоростью диффузии кислорода к реакционной поверхнрсти, т. е.
При некоторой температуре скорость химической реакции становится соизмеримой со скоростью доставки кислорода к реакционной поверхности и тогда скорость горения становится зависящей не только от скорости химической реакции, но и от скорости доставки кислорода. В этой области, называемой промежуточной (рис. 15-1, область II, кривая 1—2), скорости протекания этих двух стадий соизмеримы, ни одной из них нельзя пренебречь и поэтому скорость процесса горения определяется формулой (15-3). С увеличением температуры скорость горения увеличивается, но в меньшей степени, чем в кинетической области, причем рост ее постепенно замедляется и, наконец, достигает своего максимума при переходе в диффузную область (рис. 15-1, область III, кривая 2—3), оставаясь далее не зависящей от температуры. При более высоких температурах в этой области скорость химической реакции настолько возрастает, что доставляемый диффузией кислород мгновенно вступает в химическую реакцию, в результате чего концентрация кислорода на поверхности становится практически равной нулю. В формуле (15-3) можно пренебречь значением 1/& по сравнению с 1/ад, тогда получим, что скорость горения определяется скоростью диффузии кислорода к реакционной поверхнрсти, т. е.
И поэтому эта область горения называется диффузионной. В диффузионной области скорость горения практически не зависит от свойств топлива и температуры. Влияние температуры сказывается лишь на изменении физических констант. В этой области на скорость горения сильно влияют условия доставки кислорода, а именно гидродинамические факторы: относительная скорость газового потока и размер частиц топлива. С увеличением скорости газового потока и уменьшением размера частиц, т. е, с ускорением доставки кислорода, скорость диффузионного горения увеличивается.
В процессе горения устанавливается динамическое равновесие между химическим процессом потребления кислорода и диффузионным процессом его доставки при определенной величине концентрации кислорода у реакционной поверхности. Концентрация кислорода у поверхности частицы зависит от соотношения скоростей этих двух процессов, при преобладании скорости диффузии она будет приближаться к концентрации в потоке, повышение же скорости химической реакции вызывает ее понижение.
Процесс горения, протекающий в диффузионной области, может перейти в промежуточную (кривая 1'—2') или даже в кинетическую область при усилении диффузии, например, при повышении скорости потока или уменьшении размера частицы.
Таким образом, при увеличении скорости газового потока и при переходе к мелким частицам процесс сдвигается в сторону кинетического горения. Рост температуры сдвигает процесс в сторону диффузионного горения (рис. 15-1, кривая 2'—3').
Протекание гетерогенного горения в той или иной области для какого-либо частного случая зависит от данных конкретных условий. Основной задачей исследования процесса гетерогенного горения является установление областей протекания горения и выявление количественных закономерностей для каждой области.